إذا استخدمنا الفولتميتر في البطارية ، فسنكون قادرين على تحديد الفرق في الجهد (U أو ddp) أو القوة الدافعة الكهربائية (emf أو E) بين القطبين. ومع ذلك ، لا يمكن تحديد إمكانات الاختزال أو الأكسدة لكل قطب بهذه الطريقة.
احتاج العلماء إلى معرفة هذه القيم لدراسة عمليات تقليل الأكسدة ، لذلك قاموا بتأسيس أ دولة مرجعية. هذا يعني أنه تم الاتفاق على قياس جهد كل قطب كهربائي بالنسبة إلى قطب كهربائي آخر وفقًا للشروط القياسية التالية:
• يجب أن تكون درجة الحرارة 25 درجة مئوية.
• الضغط عند 1.0 ضغط جوي.
• يجب أن يكون تركيز المحلول الذي يغطس فيه المعدن 1.0 مول / لتر.
وهكذا ، كان القطب المختار هو قطب الهيدروجين، والممثلة أدناه:
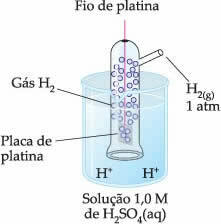
يتكون هذا القطب من سلك بلاتيني متصل بلوحة بلاتينية لا تشارك في التفاعل داخل أنبوب يحتوي على غاز الهيدروجين ومغمور في محلول حمضي. في المثال ، كان المحلول حمض الكبريتيك.
| وفقًا للاتفاقية ، تم تعيين قيمة قطب الهيدروجين القياسي صفرالكثير من أجل E.0أحمر أما بالنسبة لـ E.0أوكسي. |
وبالتالي ، للعثور على القيمة المحتملة لأي قطب كهربائي آخر ، نقوم فقط ببناء كومة من القطب الذي نريده باستخدام قطب الهيدروجين القياسي وقياس ddp باستخدام مقياس الفولتميتر. ستكون القيمة المعروضة على الفولتميتر هي إمكانات القطب المطلوب ، حيث أن قيمة الهيدروجين تساوي صفرًا.
على سبيل المثال ، نقوم بربط قطب الزنك مع قطب الهيدروجين لمعرفة إمكانات الاختزال الخاصة به:
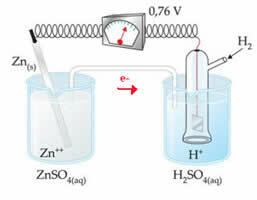
وفقًا للمخطط أعلاه ، حدد الفولتميتر فرق الجهد على أنه يساوي +0.76 (؟ E0 = +0.76). نلاحظ أيضًا أن قطب الزنك قد تأكسد ، لذا فهو الأنود ؛ وانخفض قطب الهيدروجين لكونه الكاثود.
اذا لدينا:
؟ E0 = E0red (كاثود) - E0 أحمر (الأنود)
0.76 = 0.00 - E0 أحمر (Zn)
E0 أحمر (Zn) = 0.00-0.76
E0 أحمر (Zn) = -0.76
تعني القيمة السالبة أن تيار الإلكترون يتدفق من قطب الزنك (الأنود) إلى قطب الهيدروجين ، وبالتالي يتصرف مثل الكاثود. إذا كانت موجبة ، فسيكون العكس ، وسيعمل قطب الهيدروجين مثل القطب الموجب. يمكن ملاحظة ذلك عندما نربط قطبًا نحاسيًا بقطب هيدروجين قياسي:
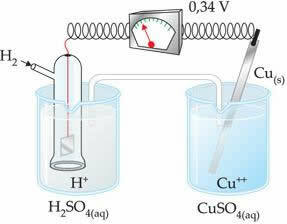
؟ E0 = E0red (كاثود) - E0 أحمر (الأنود)
-0.34 = 0.00- E0 أحمر (Zn)
E0 أحمر (Zn) = 0.00 + 0.34
E0 أحمر (Zn) = +0.34
وبالتالي ، من الممكن تحديد إمكانات الاختزال والأكسدة للأنواع الكيميائية الأكثر تنوعًا. ومع ذلك ، يوصي الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) باستخدام إمكانات الاختزال فقط. وبغض النظر عن المعدن المستخدم ، في تمثيل البطارية ، يأتي قطب الهيدروجين أولاً ، على سبيل المثال:
Pt - H2 (g) 1atm / H3O1 + (aq) 1 mol / L // Cu2 + (aq) 1 mol / L / Cu
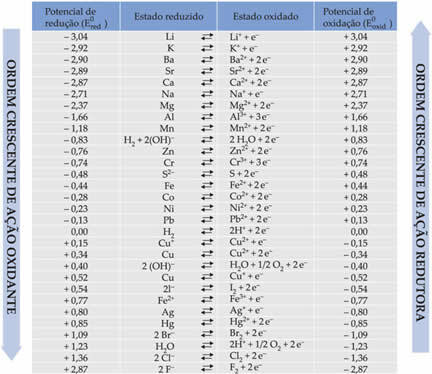
المدرجة أدناه في الجدول هي الإمكانات التي تم تحقيقها من خلال هذه الطريقة لاستخدام قطب الهيدروجين القياسي ، جنبًا إلى جنب مع التفاعلات شبه الخاصة بكل منها:
بقلم جينيفر فوغاسا
تخرج في الكيمياء
فريق مدرسة البرازيل
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/medicao-dos-potenciais-eletroquimicos.htm

