نشر وراقة قانونان اقترحهما الكيميائي الاسكتلندي توماس جراهام ، في القرن التاسع عشر ، بناءً على دراساته حول مخاليط الغاز وسلوك غازات عند المرور بجدران الحاوية.
من بين الملاحظات التي أدلى بها توماس جراهام حول سلوك الغازات فيما يتعلق بالانتشار والانصباب ، يمكننا تسليط الضوء على ما يلي:
يميل الغاز دائمًا إلى المرور عبر الثقوب الصغيرة الموجودة في مادة الحالة الصلبة ؛
كلما كان ملف كتلة الجزيء الغاز ، كلما زادت صعوبة المرور عبر ثقوب المادة الصلبة ؛
كلما انخفضت كثافة الغاز ، زادت سرعة حركته ؛
كلما ارتفعت درجة الحرارة التي يتعرض لها الغاز ، زادت السرعة التي ينتشر بها في البيئة أو يمر عبر الفتحة ؛
- لا يبقى الغاز ثابتًا أبدًا في مكان معين.
تعريف
تعريف إنها ظاهرة فيزيائية تتمثل في قدرة الغاز على الانتشار (أي الانتشار) في جميع أنحاء مساحة المنطقة أو داخل الحاوية. لهذا السبب ، يمكننا القول أنه داخل الفضاء ، لا يقتصر الغاز أبدًا على مكان واحد.

تمثيل حدوث البث
بالإضافة إلى ذلك ، يمكننا تحديد تعريف لا تزال السعة التي يجب أن يختلط بها غاز مع آخر ، عند وضعها في نفس الحاوية ، مما يشكل خليطًا غازيًا متجانسًا.
مثال على ذلك عندما تخرج الغازات من عوادم المركبات. على الرغم من أنها سامة ، فإنها لا تسبب ضررًا قصير المدى للإنسان ، حيث تنتشر في جميع أنحاء الهواء الجوي ، وبالتالي تقلل من تركيزها.
التدفق
التدفق إنها ظاهرة فيزيائية تتكون من مرور الغاز عبر الثقوب الموجودة في جدران حاوية معينة ، أي أنها تتكون من خروج غاز من بيئة إلى أخرى.

تمثيل حدوث السيول
مثال على ذلك هو عندما يتم نفخ البالونات لحفلة ، وفي اليوم التالي ، يتم تفريغها جميعًا ، كل ذلك بسبب الهواء المتسرب عبر الفتحات الموجودة في البالونات.
الحسابات المتعلقة بالانتشار والانصباب
يمكننا أن نحسب ، وفقًا للمعادلات التي اقترحها جراهام ، سرعة أداء الغاز الانتشار أو الانصباب. وفقًا لغراهام ، فإن معدلات الانتشار والانصباب لغازين مختلطين في حاوية هي دائما متناسبة عكسيا مع مربع كثافتها النسبية أو كتلها المولية.
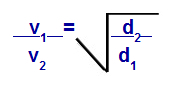
قانون جراهام فيما يتعلق بالكثافة
الخامس1 = السرعة (الانصباب أو الانتشار) للغاز 1 في الخليط ؛
الخامس2 = سرعة (انصباب أو انتشار) الغاز 2 في الخليط ؛
د1 = كثافة الغاز 1 الخليط ؛
د2 = كثافة الغاز 2 من الخليط ؛
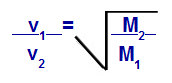
قانون جراهام بشأن الكتلة المولية
الخامس1 = السرعة (الانصباب أو الانتشار) للغاز 1 في الخليط ؛
الخامس2 = سرعة (انصباب أو انتشار) الغاز 2 في الخليط ؛
م1 = الكتلة المولية للغاز 1 من الخليط ؛
م2 = الكتلة المولية للغاز 2 في الخليط.
بي ديوغو لوبيز دياس
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm
