ال حركية الكيميائية هو مجال يدرس العوامل التي تؤثر على معدل تطور التفاعلات الكيميائية ، أي السرعة التي تحدث بها. هناك المزيد والمزيد من الأبحاث حول هذا المجال ، حيث نريد غالبًا تسريع بعض ردود الفعل أو إبطاء البعض الآخر. هذا مهم بشكل خاص للصناعات وهذا البحث له عواقب تكنولوجية مهمة.
ولكن نظرًا لأن سرعة التفاعل يمكن أن تختلف في كل فترة زمنية ومن مادة إلى أخرى ، فمن المعتاد حساب متوسط سرعة رد الفعل.
ضع في اعتبارك التفاعل العام التالي ، حيث تكون المعاملات عبارة عن أحرف صغيرة ويتم تمثيل المواد المتفاعلة والمنتجات بأحرف كبيرة:
أ أ + ب ب ← ج ج + د د
سيتم إعطاء متوسط سرعة هذا التفاعل قسمة متوسط معدل تفاعل أي من المواد المتفاعلة أو متوسط معدل تكوين أي من المنتجات على معاملها الخاص في المعادلة الكيميائية. يتم إعطاء هذا بواسطة:
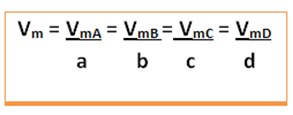
على سبيل المثال ، ضع في اعتبارك تفاعل تحلل بيروكسيد الهيدروجين:
ساعاتين2ا2 (aq) → 2 ح2ا(1) + 1 س2 (ز)
لنفترض أنه في دقيقة واحدة تشكل 0.3 مول / لتر من الهيدروجين2O و 0.15 مول / لتر من O2، بينما يتحلل 0.3 مول / لتر من H22ا2، أي أن متوسط معدلات تحلل وتشكيل هذه المواد في التفاعل هي:
الخامسmH2O2 = 0.3 مول / لتر. دقيقة
الخامسmH2O = 0.3 مول / لتر. دقيقة
الخامسم 2 = 0.15 مول / لتر. دقيقة
سيتم العثور على متوسط سرعة التفاعل العالمي بأخذ إحدى هذه القيم وتقسيمها على المعامل المعني في المعادلة:
الخامسم = الخامسmH2O2 = 0.3 مول / لتر. دقيقة = 0.15 مول / لتر. دقيقة
2 2
الخامسم = الخامسmH2O = 0.3 مول / لتر. دقيقة = 0.15 مول / لتر. دقيقة
2 2
الخامسم = الخامسم 2 = 0.15 مول / لتر. دقيقة = 0.15 مول / لتر. دقيقة
1 1
لاحظ أن القيم الثلاث متساوية ، وبالتالي ، فإن معدل التفاعل هو نفس وظيفة أي مادة متفاعلة أو منتج ، في نفس الفترة الزمنية.
ومع ذلك ، كيف تم العثور على قيم متوسط سرعات كل مادة من المواد المشاركة في هذه التفاعلات؟
يمكن حسابها قسمة التغير في تركيز المادة (الكاشف أو المنتج) على الفترة الزمنية. إذا أردنا تحديد متوسط السرعة لواحد من الكواشف من رد الفعل ، سيتعين علينا وضع إشارة سلبية قبل ذلك ، أو النظر في قيمة التركيز في الوحدة || ، نظرًا لأن تركيز المادة المتفاعلة يتناقص بمرور الوقت ، ستكون قيمة السرعة سالبة ، لكن لا توجد سرعة سالبة.

على سبيل المثال ، ضع في اعتبارك تفاعل تحلل غاز الأوزون التالي (O3 (ز)) في غاز الأكسجين (O2 (ز)):
2 س3 (ز) → 3 س2 (ز)
لنفترض أنه في البالون كان هناك 10 مولات من غاز الأوزون ، ولكن بعد دقيقة واحدة ، لم يتبق سوى 4 مولات ؛ هذا يعني أن 6 مولات من الأوزون تحولت إلى غاز أكسجين. اذا لدينا:
2 س3 (ز) → 3 س2 (ز)
ر = 0 دقيقة 2 مول / لتر 0 مول / لتر
شكلت النفقات
6 مول / لتر 9 مول / لتر
ر = 1 دقيقة 4 مول / لتر 9 مول / لتر
لاحظ أنه نظرًا لأن نسبة التفاعل هي 2: 3 ، فعندئذ إذا تم استخدام 6 مولات من O3، تم تكوين 9 مول من O2. لذلك ، بعد دقيقة واحدة ، لدينا متوسط السرعات التالية:
الخامسم = - ∆ [إن3]
ر
الخامسم = - ([س3 أخيرًا - ا3 مبدئي])
رنهائي - تمبدئي
الخامسم = - ([4 - 10])
1– 0
الخامسم = 6 مول / لتر. دقيقة← لمدة دقيقة واحدة ، تفاعل 6 مول من الأوزون في كل لتر من النظام.
الخامسم = ∆ [إن2]
ر
الخامسم = ([س2 نهائي - ا2 مبدئي])
رنهائي - تمبدئي
الخامسم = ([9 - 0])
1– 0
الخامسم = 9 مول / لتر. دقيقة← خلال دقيقة واحدة ، تم تكوين 9 مولات أكسجين في كل لتر من النظام.
يوضح لنا هذا أنه يمكننا حساب متوسط السرعة كدالة للمواد المتفاعلة أو كدالة للمنتجات.
الآن ، إذا أردنا حساب متوسط سرعة هذا التفاعل العالمي ، فافعل ما أوضحناه في البداية: اقسم كل من هذه السرعات على معاملات كل منها في المعادلة الكيميائية:
الخامسم = الخامسم 3 = 6 مول / لتر. دقيقة = 3 مول / لتر. دقيقة
2 21
الخامسم = الخامسم 2 = 9 مول / لتر. دقيقة = 3 مول / لتر. دقيقة
3 3
الخامسم = الخامسم 3 = الخامسم 2
23
بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm

