ا نصف القطر الذري (ص) عادة ما يتم تعريفه على أنه نصف المسافة بين نواتين من الذرات المجاورة، حيث يمثل الشكل أدناه:

نصف القطر الذري
يختلف نصف القطر الذري من ذرة إلى أخرى وفقًا لعائلتها والفترة الموجودة في الجدول الدوري. فيما يتعلق بالعناصر التي تنتمي إلى أ نفس العائلة ، يزيد نصف قطرها الذري مع زيادة العدد الذري.، وهذا هو ، من أعلى إلى أسفل. لأنه ، بهذا المعنى ، يعني أنه من ذرة إلى أخرى ، ازداد مستوى الطاقة أو الطبقة الإلكترونية ، وبالتالي فإن نصف قطرها يزيد بشكل متناسب.
فيما يتعلق بالعنصر في نفس الفترة، وهذا هو ، أفقيا ، يزيد نصف القطر من اليمين إلى اليسار ، أو كلما انخفض العدد الذري. هذا لأن لديهم جميعًا نفس عدد الطبقات ، ما يصنع الفرق هو مقدار الإلكترونات في هذه الطبقات ، وكلما زاد عدد الإلكترونات ، زاد الجذب للنواة ، وبالتالي قل نصف قطر ذرة.

اتجاه نمو نصف القطر الذري وفقًا للعائلة والفترة في الجدول الدوري
ومع ذلك ، يمكن أن يختلف نصف القطر الذري اعتمادًا على الاتصال الذي يتم إجراؤه. دعونا نرى كيف يحدث هذا:
* الرابطة الأيونية: إذا شكلت الذرة أ الكاتيون ، سيقل نصف القطر الذري، نظرًا لفقدان إلكترون واحد أو أكثر ، فإن النواة ستجذب الإلكترونات بشكل أكثر كثافة. الآن إذا
تشكل أنيون ، أي اكتساب إلكترونات ، سيزداد نصف قطر الذرة، حيث أن الشحنة الكلية للغلاف الكهربائي ستكون أكبر من إجمالي شحنة النواة ، مما يقلل من جاذبيتها. كلما زادت الإلكترونات التي تكتسبها أو تفقدها ، كلما زاد الاختلاف في حجم الحزمة.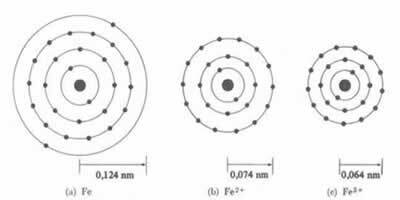
دائمًا ما يكون قطر أو نصف قطر الكاتيون أصغر من قطر أو نصف قطر الذرة
أيضا ، في سلسلة من الأيونات المتساوية الإلكترونية، التي تحتوي على نفس الكمية من الإلكترونات ومستويات الطاقة ، سيكون للأيون صاحب أصغر عدد ذري نصف قطر أكبر. على سبيل المثال ، الأيونات 13ال3+, 12ملغ2+, 11في1+, 9F-1, 8ا2- و 7ن-3، تحتوي جميعها على 10 إلكترونات ومستويين إلكترونيين. ولكن ما له أكبر نصف قطر هو 7ن-3لأنه يحتوي على أصغر عدد ذري (Z = 7).
* الرابطة التساهمية: عندما تكون ذرتان رابطة تساهمية ، إذا كانت الذرتان متساويتين، كما في حالة غاز الهيدروجين (ح2), يمكن للمرء أن يتحدث عن نصف القطر التساهمي (ص) ، وهو نصف طول الرابطة (د) ، أي نصف المسافة التي تفصل بين النواتين. برغم من، إذا كانت الرابطة مصنوعة من ذرات مختلفة، كما في حالة كلوريد الهيدروجين (HCl) ، الطول أو المسافة (د) سيكون مجموع نصف القطر التساهمي (r1 + r2) للذرات المشاركة في التساهم.
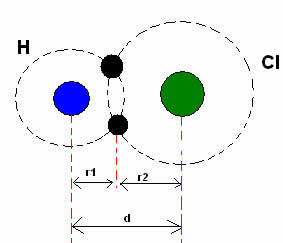
مجموع نصف القطر الذري في رابطة تساهمية.
بالطبع ، يجب أن نتذكر أن هذه المسألة أكثر تعقيدًا ، حيث يمكن أن يختلف نصف القطر التساهمي للذرة لأنها ترتبط بذرات مختلفة أخرى.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/variacao-raio-atomico-ligacoes-quimicas.htm

