عادة ما تكون ردود أفعال التحليل الكهربائي المائي و التحليل الكهربائي البركاني يتم إجراؤها باستخدام أقطاب الجرافيت والبلاتين ، والتي لا تشارك في التفاعل ؛ إنهم يجرون التيار الكهربائي فقط. ومع ذلك ، هناك بعض الحالات المحددة حيث يكون من الضروري استخدام أقطاب كهربائية نشطة، أي التي تخضع للاختزال والأكسدة.
حالات الاستخدام الرئيسية لهذه الأقطاب الكهربائية التي تشارك في عملية الأكسدة والاختزال هي: أ تنقية المعادن كهربائيا، مثل الزنك والكوبالت والنيكل وخاصة النحاس ؛ وكذلك الكهربائي. دعونا نرى كيف تحدث كل حالة:
• تنقية النحاس كهربائيا: يمكن أن ينتج عن تكرير النحاس الإلكتروليتي درجة نقاء تبلغ حوالي 99.9٪ ويستخدم بشكل أساسي في التصنيع الأسلاك النحاسية التي ، إذا كانت تحتوي على أقل كمية من الشوائب ، فقد يكون لها قدرتها على توصيل تيار كهربائي شديد تقلص.
لاحظ كيف تحدث هذه العملية ، مع رؤية التخطيطي لحاوية إلكتروليتية مجمعة أدناه:

يتم تطبيق فرق الجهد على محلول كبريتات النحاس المائي (CuSo4 (عبد القدير)) - التي توصل الكهرباء - بحيث يفقد القطب الموجب ، وهو نحاس معدني غير نقي ، الإلكترونات ، أي يخضع للأكسدة ، ويطلق الكاتيونات (Cu)
2+) ، والتي يتم ترسيبها على اللوحة السلبية. يمكن أن يكون هذا صفيحة بلاتينية خاملة ، أو الأفضل ، صفيحة نحاسية نقية. إنه يشكل الكاثود ، الذي يتقلص مع ترسيب النحاس فيه. وبالتالي ، فإن شبه التفاعلات التي تحدث في الأقطاب الكهربائية هي: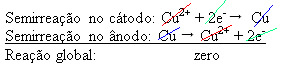
حقيقة أنها أعطت نتيجة صفرية تشير إلى أنه لم يكن هناك تفاعل كيميائي ، ولكن فقط نقل النحاس. يوجد في أسفل الحاوية المواد الأخرى غير النقية التي كانت موجودة في النحاس مثل الذهب والفضة والسيليكا (الرمل) والمعادن الأخرى ، والتي يمكن حتى بيعها.
• الكهربائي: يتم وضع طلاء معدني على مادة يجب حمايتها من التآكل.
المعدن المختار للطلاء - والذي يمكن أن يكون الكروم (طلاء الكروم) ، النيكل (طلاء النيكل) ، الفضة (طلاء الفضة) ، الذهب (التذهيب) أو الزنك (الجلفنة) - سيكون القطب الموجب ، القطب الموجب ، الذي يخضع للأكسدة ، ويفقد الإلكترونات. يخضع للأكسدة بدلاً من المادة التي تم حمايتها ، لأن إمكانية الاختزال أكبر.
القطب السالب ، أي الكاثود ، الذي يستقبل هذه الإلكترونات ويخضع للاختزال ، هو المادة نفسها التي تم تغطيتها. بهذه الطريقة ، تظل محمية حتى لو تم انتهاك سطحها بطريقة ما.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm