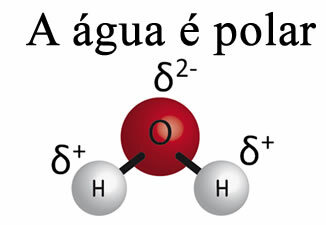
لا يمكن للماء وحده إزالة الشحوم من المواد. هذا بسبب الالماء قطبي، كما هو موضح في الصورة أدناه ، بسبب الاختلاف في الكهربية الموجودة بين ذرات الهيدروجين والأكسجين في جزيئاتهم. من ناحية أخرى، الدهون غير قطبية وبالتالي فإن الماء لا يذيب الدهون.
بالإضافة إلى ذلك ، فإن الماء له ما يسمى التوتر السطحي. يمكنك فهم هذا بشكل أفضل في النص. التوتر السطحي للماء، ولكنه في الأساس نوع من الغشاء المرن أو الغشاء الذي يتشكل على سطح الماء ، مما يمنعه من اختراق الأقمشة والمواد الأخرى لإزالة الأوساخ. تجذب جزيئات الماء بعضها البعض في جميع الاتجاهات روابط هيدروجينية، ولكن جزيئات السطح تتفاعل فقط مع الجزيئات الموجودة على الجانب والأسفل ، مما يؤدي إلى اختلاف في قوى التماسك، مما يؤدي إلى تقلص جزيئات السطح وتشكيل هذا التوتر السطحي.
وهنا يأتي دور الصابون والمنظفات (من اللاتينية يزيل السموم = واضح) ، والتي تسمى أيضًا العوامل النشطة السطحيةحيث أن لها القدرة على تقليل التوتر السطحي للماء ، بالإضافة إلى أنها تتفاعل مع كل من الماء والدهون. كيف يحدث هذا؟
يحتوي الصابون والمنظفات على أملاح الأحماض الدهنية ، وهي عبارة عن جزيئات طويلة تتكون من أ
جزء غير قطبي (ما هو نافرة من الماء – هيدرو = ماء ؛ الرهاب = النفور) وأ نهاية قطبية (محبة للماء – هيدرو = ماء ؛ phyla = صديق). يوجد أدناه هيكل نموذجي للصابون: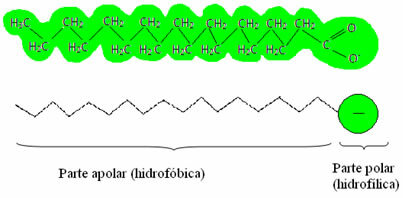
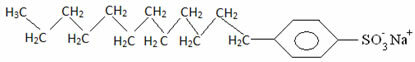
بشكل عام ، المنظفات عبارة عن أملاح أحماض سلفونيك طويلة السلسلة:
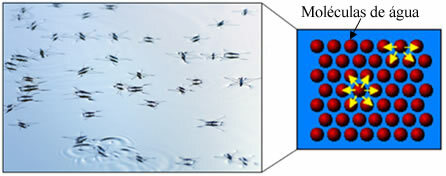
وبالتالي فإن الجزء غير القطبي من هذه الجزيئات الموجودة في الصابون والمنظفات يتفاعل مع الدهون ، بينما تتفاعل النهاية القطبية مع الماء ، وتجمع نفسها في كريات صغيرة ، دعا من micelles، حيث تواجه الأجزاء المحبة للماء السطح الخارجي للمذيلة في اتصال مع جزيئات الماء ، و تبقى الدهون في الداخل ، على اتصال مع الجزء غير القطبي أو الكارهي للماء ، وهي عملية مماثلة لتلك الموضحة في الصورة. إتبع:
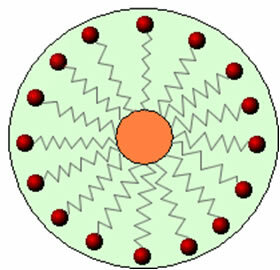
بهذه الطريقة ، تحبس الأوساخ الدهنية في وسط المذيلات ويمكن إزالتها. نقطة أخرى هي أن المنظفات والصابون لها القدرة على خفض التوتر السطحي للماء ، لأن تقليل التفاعلات بين جزيئاتها ، مما يسهل عليها اختراق المواد المختلفة لإزالة التراب.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/quimica-dos-saboes-detergentes.htm

