تخيل أنك أضفت 10 جم من ملح الطعام (كلوريد الصوديوم - NaCl) إلى كوب يحتوي على 100 جرام من الماء عند درجة حرارة 20 درجة مئوية. بعد الخلط ، ترى أن الملح قد ذاب تمامًا ، لذلك قررت إضافة المزيد من الملح. في مرحلة ما ، لن تكون قادرًا على إذابة الملح بهذه الكمية من الماء ، وأي ملح مضاف سيغرق في قاع الكوب ، بغض النظر عن مدى صعوبة محاولتك خلطه.
عندما يحدث ذلك ، نقول إن الحل هو مشبع وأن معامل الذوبان. لذلك يمكننا تحديد معامل الذوبان على النحو التالي:
“معامل الذوبان هو أقصى كمية من المذاب التي تذوب في كمية معينة من المذيب ، عند درجة حرارة معينة. "
معامل الذوبان للملح في الماء ، على سبيل المثال ، يساوي 36 جم من كلوريد الصوديوم / 100 جم من الماء عند درجة حرارة 20 درجة مئوية. لا يمكن إذابة جرام إضافي من الملح في هذه الكمية من الماء وعند درجة الحرارة هذه ، مثل معامل الذوبان خاص بكل مادة. إذا قمنا بتغيير المذاب ، على سبيل المثال ، استبدال ملح الطعام بـ NH4Cl ، هذا له معامل ذوبان يساوي 37.2 جم في 100 جرام من الماء عند 20 درجة مئوية.
علاوة على ذلك، المادة نفسها لها قابلية ذوبان مختلفة في مذيبات مختلفة. بينما الملح قابل للذوبان في الماء ، فهو غير قابل للذوبان عمليًا في الأسيتون أو أسيتات الإيثيل (مذيب يستخدم لإزالة الصقيل).
نقطة أخرى هي أنه كلما تم ذكر معامل الذوبان في كمية معينة من المذيب ، من الضروري أيضًا تحديد درجة الحرارة، لأن هذا عامل تداخل. على سبيل المثال ، إذا أخذنا 100 جم من الماء عند 20 درجة مئوية وأضفنا 40 جم من الملح ، فإن 36 جم سوف تذوب و 4 جم سوف تشكل الراسب. ولكن إذا أخذنا هذا المحلول للتسخين ، فسنرى أن الـ 4 جم سوف تذوب مع ارتفاع درجة الحرارة.
يوضح لنا هذا أن نفس المذاب المذاب في نفس الكمية من المذيب له معاملات ذوبان مختلفة كلما زادت درجة الحرارة.
انظر المثال أدناه:
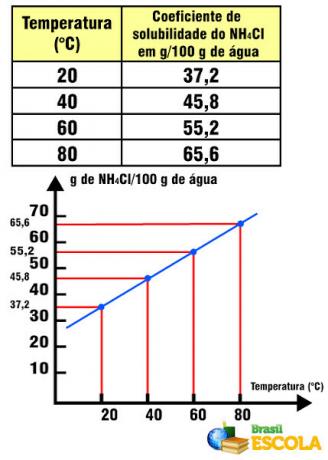
معامل الذوبان NH4Cl بالنسبة لدرجة الحرارة
لاحظ أنه في هذه الحالة ، معامل الذوبان NH4يزيد Cl مع زيادة درجة الحرارة. يحدث هذا مع معظم الأملاح في الماء. ومع ذلك ، هناك حالات يتناقص فيها معامل الذوبان مع زيادة درجة الحرارة ، كما في حالة Ce2(فقط4)3. هناك أيضًا حالات لا يوجد فيها مثل هذا التباين الملحوظ في معامل الذوبان ، كما يحدث مع ملح الطعام. انظر الى هذا في النص الرسوم البيانية لمنحنيات الذوبان.
قد يكون بإمكاننا أيضًا ، في بعض المواقف المحددة ، إذابة كمية من المذاب في المذيب أكبر من معامل الذوبان الخاص به ، وبالتالي الحصول على ما يسمى محلول مفرط التشبع. على سبيل المثال ، تخيل أن المحلول يتكون من 100 جرام من الماء ، عند 20 درجة مئوية ، و 40 جرام من ملح الطعام (مع 36 جم. مذاب و 4 جم مترسب) ، يسخن حتى يصل إلى درجة حرارة يكون عندها كل المذاب يذوب نفسك. ثم يترك هذا المحلول ليرتاح حتى يبرد حتى يصل إلى درجة حرارة الغرفة ، والتي تقترب من 20 درجة مئوية.
إذا لم يكن هناك أي اضطراب في المحلول ، فسيظل المذاب الإضافي ذائبًا ، وبالتالي يشكل محلولًا مفرط التشبع. ومع ذلك ، فإن هذا النوع من المحاليل غير مستقر للغاية ، وأي حركة مفاجئة يمكن أن تتسبب في تبلور الكمية التي تزيد عن معامل الذوبان لدرجة الحرارة هذه. وهكذا ، كان الحل مفرط التشبع سيصبح مشبع بجسم الخلفية.
الحالة الأخيرة هي محلول غير مشبع، وهو عندما تكون كمية المذاب المذاب أقل من قيمة معامل الذوبان. مثال على ذلك هو إذابة 10 جم من كلوريد الصوديوم في 100 جم من الماء عند 20 درجة مئوية.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/coeficiente-solubilidade.htm
