ال أكسدة خفيفة في الألكينات هو تفاعل عضوي يتم إجراؤه عند وجود ألكين يوضع في وسط يتكون من قاعدة بها ماء وملح برمنجنات البوتاسيوم (KMnO4) ، الملح الذي يطلق عليه عادة كاشف باير.
المنتج الذي تم تشكيله يسمى كحول متجاورة ، أي الكحولات التي تحتوي على مجموعتين هيدروكسيل (OH-) موضوعة على الكربون المجاور ، كما في الصيغة العامة التالية:
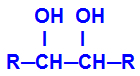
ملاحظة: يمكن أن تكون R ذرات جذرية أو هيدروجين.
كاشف باير
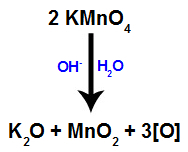
عندما كاشف باير (KMnO4) مع الماء في وجود قاعدة غير عضوية (OH-) ، يتفاعل ويشكل أكسيد البوتاسيوم (K.2O) ، وثاني أكسيد المنغنيز (MnO2) والأكسجين الناشئ (الأكسجين الحر الذي يمثله [O]). انظر المعادلة المتوازنة للعملية.

هذه الأكسجين الوليدة المتكونة من كاشف باير مسؤولة عن تفاعل الأكسدة الخفيف في الألكينات (كما سنرى في العناصر التالية).
آليات تفاعل أكسدة خفيف في الألكينات
الآلية الأولى: تكوين الأكسجين الناشئ من كاشف باير ؛
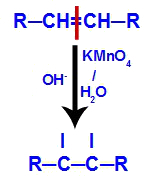
الآلية الثانية: هجوم الأكسجين الناشئ على الرابطة المزدوجة الموجودة في الألكين ، مما يتسبب في تعطيل رابطة pi وما يترتب على ذلك من تكوين تكافؤ حر في كل من ذرات الكربون المتضمنة في رابط بي.
الآلية الثالثة: تتحد الأكسجين الناشئ مع الهيدرونيوم (H
+) تتكون من التأين الذاتي للماء ، مما أدى إلى ظهور مجموعات الهيدروكسيل (OH-).
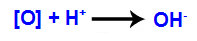
الآلية الرابعة: تم تكوين اتصال الهيدروكسيل في كل من التكافؤات الحرة الموجودة على الكربون حيث كانت رابطة pi ، مما أدى إلى كحول ثنائي متجاور.

أمثلة على تفاعلات الأكسدة الخفيفة في الألكينات
→ تفاعل أكسدة خفيف على but-2-ene
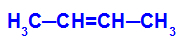
الصيغة الهيكلية لـ but-2-ene
في البداية ، يتم كسر الرابطة المزدوجة بين الكربون 2 و 3 من الألكين بواسطة هجوم الأكسجين الناشئ ، مما يؤدي إلى تكوين تكافؤ حر (أثر عمودي) على الكربون 2 و 3.

كسر رابطة pi بين الكربون 2 و 3 في but-2-ene
ثم ينضم الأكسجين الناشئ إلى الهيدرونيوم (H+) من تأين الماء ، وتشكيل مجموعات الهيدروكسيل (OH-) ، والتي ترتبط بالتكافؤ الحر للكربون 2 و 3 ، مما يؤدي إلى كحول ديال متجاور.
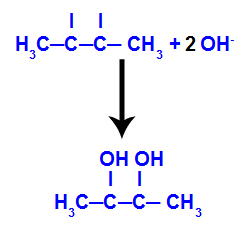
يتكون الكحول الوريدي من but-2-ene
→ تفاعل أكسدة خفيف على 2-ميثيل بروبين
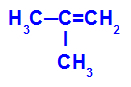
الصيغة الهيكلية لـ 2-ميثيل بروبين
في البداية ، يتم كسر الرابطة المزدوجة بين الكربون 1 و 2 من الألكين من خلال هجوم الأكسجين الناشئ ، مما يؤدي إلى تكوين تكافؤ حر (أثر عمودي) على الكربون 1 و 2.
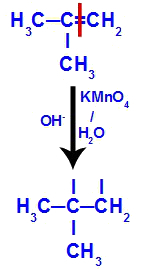
كسر رابطة pi بين الكربون 1 و 2 في 2-ميثيل-بروبين
ثم ينضم الأكسجين الناشئ إلى الهيدرونيوم (H+) من تأين الماء ، وتشكيل مجموعات الهيدروكسيل (OH-) ، والتي ترتبط بالتكافؤ الحر للكربون 1 و 2 ، مما يؤدي إلى كحول ديال متجاور.
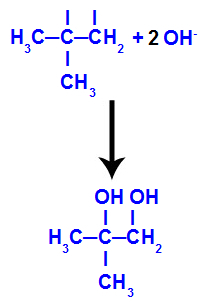
يتكون الكحول الوريدي من 2-ميثيل-بروبين
بي ديوغو لوبيز دياس
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/oxidacao-branda-alcenos.htm

