يحدث الترابط الأيوني بين الأيونات ، كما يوحي اسمه. لأن لها شحنة معاكسة ، فإن الكاتيونات (عنصر ذو شحنة موجبة) والأنيونات (عنصر ذو شحنة سالبة) تجذب بعضها البعض كهربائيا ، وتشكل الرابطة. ومع ذلك ، فإن المادة الصلبة الأيونية تتكون من تكتل من الكاتيونات والأنيونات المنظمة بأشكال هندسية محددة جيدًا ، تسمى المشابك أو المشابك البلورية.
على سبيل المثال ، يتكون الملح (كلوريد الصوديوم) من خلال النقل النهائي للإلكترون من الصوديوم إلى الكلور ، مما يؤدي إلى ظهور كاتيون الصوديوم (Na+) وأنيون الكلوريد (Cl-). من الناحية العملية ، لا يشمل هذا التفاعل ذرتين فحسب ، بل يشمل عددًا هائلاً وغير محدد من الذرات التي تشكل شبكة بلورية مكعبة الشكل ، كما هو موضح أدناه:
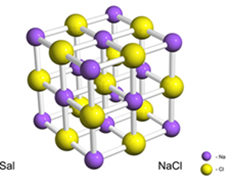
إذا نظرنا إلى بلورات الملح باستخدام المجهر الإلكتروني الماسح ، فسنرى أنها في الواقع مكعبة بسبب بنيتها الداخلية.

نظرًا لأن كل مركب أيوني يتكون بعد ذلك من عدد غير محدد وكبير جدًا من الأيونات ، فكيف يمكننا تمثيل مركب أيوني؟
الصيغة المستخدمة عادة هي صيغة الوحدة، وهو الذي يمثل النسبة التي يعبر عنها أصغر عدد ممكن من الكاتيونات والأنيونات التي تشكل الشبكة البلورية ، بحيث يتم تحييد الشحنة الكلية للمركب
. لكي يحدث هذا ، من الضروري أن يكون عدد الإلكترونات التي تتخلى عنها الذرة مساويًا لعدد الإلكترونات التي تتلقاها الذرة الأخرى.بعض الجوانب حول صيغة الوحدة للمركبات الأيونية مهمة ، انظر بعضًا:
- اكتب دائمًا الكاتيون أولاً ثم الأنيون ؛
- نظرًا لأن كل مركب أيوني محايد كهربائيًا ، فلا يلزم تدوين الشحنات الأيونية الفردية ؛
- تشير الأرقام المنخفضة التي تظهر على الجانب الأيمن من كل أيون إلى نسبة ذرات الكاتيون إلى الأنيون. تسمى هذه الأرقام مؤشرات ولا يتم كتابة الرقم 1.
على سبيل المثال ، في حالة كلوريد الصوديوم ، لدينا صيغة الوحدة الخاصة به هي NaCl ، حيث لدينا 1 كاتيون صوديوم لكل أنيون كلوريد.
شاهد مثالاً آخر ، Al3+ بثلاث شحنة موجبة ، في حين أن F- يحتوي على سلبي واحد فقط ، لذلك هناك حاجة لثلاثة أنيون فلوريد لتحييد المركب. وبالتالي ، نستنتج أن صيغة الوحدة الخاصة بها هي AlF3.
تتمثل إحدى الطرق البسيطة للوصول إلى صيغة الوحدة للمركب الأيوني في استبدال رسومه بمؤشراته ، كما هو موضح بطريقة عامة أدناه:
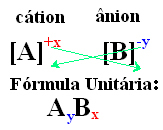
أمثلة:

الصيغة الأخرى المستخدمة لتمثيل المواد الأيونية هي صيغة لويس أو صيغة إلكترونية، ماذا او ما يمثل الإلكترونات من غلاف التكافؤ لأيونات "الكرات" حول رمز العنصر. في حالة الملح لدينا:

بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm
