يحدث الترابط التساهمي عندما تشترك ذرتان في أزواج من الإلكترونات من أجل الحصول على التكوين الإلكتروني لـ غاز نبيل (مع 8 إلكترونات في غلاف التكافؤ أو 2 ، في حالة أولئك الذين لديهم غلاف K فقط) ، وفقًا لقاعدة ثماني.
ومع ذلك ، هناك حالات خاصة من الروابط التساهمية التي يأتي زوج الإلكترون المشترك فقط من إحدى الذرات المستقرة بالفعل. في السابق ، كان يسمى هذا النوع من الرابطة التساهمية dative، اليوم يطلق عليه أكثر شيوعًا تنسيق.
شاهد بعض الأمثلة لفهم كيفية حدوث ذلك:
- ثاني أكسيد الكربون (أول أكسيد الكربون):
يحتوي الكربون على 4 إلكترونات في غلاف التكافؤ. لذلك ، وفقًا لقاعدة الثمانيات ، لكي تكون مستقرة ، يجب أن تتلقى 4 إلكترونات أخرى ، بإجمالي 8 إلكترونات. من ناحية أخرى ، يحتوي الأكسجين على 6 إلكترونات في غلاف التكافؤ ويحتاج إلى استقبال إلكترونين للحصول على تكوين غاز النيون النبيل.
لذلك ، أولاً ، يشترك الكربون والأكسجين في زوجين من الإلكترونات بحيث يكون الأكسجين مستقرًا:
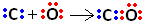
ومع ذلك ، يظل الكربون غير مستقر لأنه لا يزال يحتوي على 6 إلكترونات ويحتاج إلى 2. لذلك ، فإن الأكسجين ، الذي هو مستقر بالفعل ، يشترك في أحد أزواج إلكتروناته مع الكربون ، أي أنه يكوِّن رابطة متداخلة معه ، مما يجعله مستقرًا:

لاحظ أن الرابطة التساهمية الإحداثية يمكن تمثيلها بشرطة ، تمامًا مثل الرابطة التساهمية المشتركة.
- فقط2 (ثاني أكسيد الكبريت):
تحتوي كل ذرة كبريت وأكسجين على 6 إلكترونات في غلاف التكافؤ ، لذا فهي بحاجة إلى تلقي إلكترونين لكل منهما. في البداية ، يصنع الكبريت رابطتين تساهمية مشتركتين ، يتشاركان زوجان من الإلكترونات مع إحدى ذرات الأكسجين ، وكلاهما يظل ثابتًا مع 8 إلكترونات.
لكن ذرة الأكسجين الأخرى غير مستقرة ، لذلك يشترك الكبريت في زوج من إلكتروناته معها عبر رابطة تساهمية منسقة أو dative:
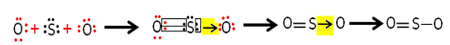
لاحظ أنه في هذه الحالة لدينا ثلاث ذرات في الجزيء ، لذلك يمكن أن يكون هناك انتقال للرابطة من ذرة إلى أخرى. يمكن أيضًا تمثيل جزيء ثاني أكسيد الكبريت على النحو التالي: O ─ S ═ O.
نسمي هذه الظاهرة الترابطية صدى. انظر إلى ثلاثة أمثلة أخرى في الجدول أدناه:
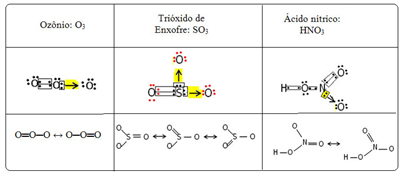
تسمى الهياكل الممكنة هياكل الرنين أو الأشكال المتعارف عليها.
يحدث هذا النوع من الروابط أيضًا في تكوين الأيونات ، كما في حالة أيونات الهيدرونيوم (H3ا+) والأمونيوم (NH4+).
أولاً ، الكاتيون H.+ يتشكل عندما يفقد الهيدروجين إلكترونه الفردي ، تاركًا إياه موجب الشحنة. لذلك سوف تحتاج إلى استقبال إلكترونين لكي تكون مستقرة. يحدث هذا من خلال رابطة dative مع الماء (في حالة أيون الهيدرونيوم) ومع الأمونيا (في حالة أيون الأمونيوم). يشاهد:

بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/ligacao-covalente-dativa-ou-coordenada.htm

