الى وظائف الأكسجين هي مجموعة من مركبات العضوية التي تحتوي على ذرات أكسجين متصلة بسلسلة الكربون. هل هم:
كحول;
كيتون;
الألدهيد;
حمض الكربوكسيل;
استر;
الأثير.
اقرأ أيضا:الهيدروكربونات - مركبات مكونة من الكربون والهيدروجين
ملخص عن وظيفة الأكسجين
وظائف الأكسجين هي مجموعة من المركبات التي تحتوي على ذرة أكسجين. الأكسجين متصلة مباشرة بسلسلة الكربون.
تتميز وظائف الأكسجين المختلفة بترتيب هيكلي محدد لـ ذرات، تسمى مجموعة وظيفية.
المجموعات الوظيفية مسؤولة عن خصائص كل وظيفة عضوية.
وظائف الأكسجين هي: الكحول ، الكيتون ، الألدهيد ، حمض الكربوكسيل ، الإستر والأثير.
درس فيديو عن وظيفة الأكسجين
ما هي وظائف الأكسجين؟
وظائف الجسم المؤكسدة هي تلك لديها ذرة أكسجين مرتبطة بذرة أكسجين كربون من سلسلة الكربون.
وظائف الأكسجين هي:
كحول؛
كيتون.
الألدهيد.
حمض الكربوكسيل
استر.
الأثير.
الوظائف العضوية من خلال مجموعتهم الوظيفية ، وهو ترتيب بنيوي للذرات أو الروابط ، مسؤول عن الخصائص المميزة لتلك المجموعة من المركبات.
أهمية وظائف الأكسجين
وجود وظائف الأكسجين في المركبات العضوية قادر على تغيير خصائص المركبات، مقارنة بالهيدروكربون المعني ، مع عدد متساوٍ من الكربون.
تتميز وظائف الأكسجين بحدوث مجموعات الهيدروكسيل أو الكربونيل أو الكربوكسيل. أ يزيد وجود ذرة الأكسجين من الطابع القطبي المركبات ، مما يجعلها أكثر ماء ، أي زيادة تقاربها ماء.
حدوث وظائف الأكسجين مسؤول أيضًا عن نوع قوة الجزيئاتالعمل بين الجزيئات. تؤثر طبيعة وشدة القوى بين الجزيئات على الذوبان ودرجات حرارة الانصهار والغليان.
يقدم الجدول أدناه مقارنة بين بعض خصائص ثلاثة مركبات لها نفس عدد ذرات الكربون ، ولكنها تختلف من خلال وجود مجموعات وظيفية مؤكسجة.
سماد عضوي | |||
البيوتان (سي4ح10) |
بوتانون (سي4ح8س) |
بوتانول (سي4ح10س) |
|
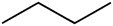 |
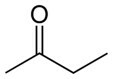 |
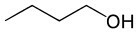 |
|
وظيفة عضوية |
الهيدروكربون |
كيتون (وظيفة الأكسجين) |
كحول (وظيفة الأكسجين) |
قطبية |
أبولار |
قطبي |
قطبي |
درجة حرارة الانصهار |
-138.3 درجة مئوية |
-86 درجة مئوية |
-89 درجة مئوية |
درجة حرارة الغليان |
-0.5 درجة مئوية |
80 درجة مئوية |
118 درجة مئوية |
القوة بين الجزيئات السائدة |
ثنائي القطب الناجم |
دائم ثنائي القطب |
روابط هيدروجينية |
كحول
الكحول العضوي يحتوي على مجموعة هيدروكسيل (-OH) مرتبطة مباشرة بالكربون المشبع، أي ذرة الكربون التي تؤسس روابط مفردة فقط.
المجموعة الوظيفية للكحولات: R-OH (هيدروكسيل).
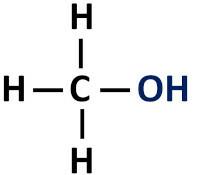
الكحوليات مصنفة حسب نوع الكربون الذي يرتبط به الهيدروكسيل. الكحولات الأولية تحتوي على الهيدروكسيل مرتبط بالكربون الأساسي. تحتوي الكحولات الثانوية على مجموعة الهيدروكسيل المرتبطة بكربون ثانوي ، بينما تحتوي الكحولات الثلاثية على مجموعة -OH الخاصة بها مرتبطة بالكربون العالي.
يسمى المركب العضوي الذي يحتوي على هيدروكسيل واحد فقط الكحول الأحادي. إذا كانت تحتوي على مجموعتين من الهيدروكسيل ، فإنها تسمى كحول ثنائي. وفوق ذلك ، تسمى الجزيئات كحول متعدد.
أ تسمية الكحوليات يتبع توصية Iupac (الاتحاد الدولي للكيمياء البحتة والتطبيقية) ، مع الأخذ في الاعتبار تجميع اسم التركيبات الكيميائية في ثلاثة أجزاء:
بادئة - تتعلق بعدد الكربون.
إنفكس - يشير إلى نوع الرابطة الكيميائية المنشأة بين ذرات الكربون.
لاحقة - تتعلق بالمجموعة الوظيفية. في حالة الكحول ، اللاحقة المستخدمة هي -مرحبًا
انظر الأمثلة:
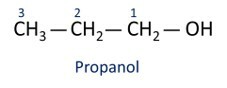
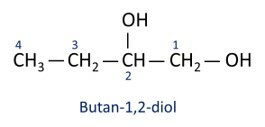
ا الكحول الرئيسي الإيثانل (CH3CH2OH) ، يستخدم كوقود ، في المشروبات الكحولية ، كمذيب كيميائي ، عامل تنظيف ومطهر.
كيتون
تتوافق وظيفة الكيتون العضوية مع مجموعة الكربونيل الوظيفية (C = O) ، وتقع بين ذرتين من الكربون من سلسلة الكربون.
المجموعة الوظيفية من الكيتونات: R.1- (C = O) –R2.

الكيتونات مصنفة حسب عدد مجموعات الكاربونيل:
Monoketones - لها مجموعة كربونيل واحدة.
Diketones - لها مجموعتان من الكربونيل.
Polytones - لديها أكثر من مجموعتين من الكربونيل.
أ تسمية الكيتونات يتبع قواعد Iupac ، ولكن مع اختلاف في تهجئة اللاحقة. يتم تحديد الكيتونات من خلال اللاحقة -على.
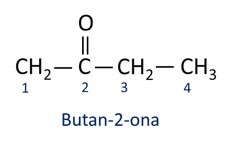
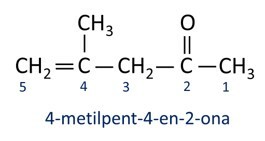
بشكل عام ، تستخدم الكيتونات في تصنيع المواد الكيميائية والمستحضرات الصيدلانية الأخرى. في الصناعة ، تستخدم الكيتونات كمذيبات للدهانات والأصباغ والورنيش. واحدة من أكثر الكيتونات شهرة هي البروبانون، المعروف شعبياً باسم الأسيتون. تستخدم حلول الأسيتون لإزالة طلاء الأظافر.
اقرأ أيضا:الأميدات - مركبات لها نيتروجين مرتبط بالكربونيل
ألدهيد
وظيفة الألدهيد العضوية هي تتميز بوجود مجموعة كاربونيل الوظيفية، التي تحتوي ذرة الكربون على رابطة هيدروجينية.
المجموعة الوظيفية للألدهيدات: H - C = O (فورميل).
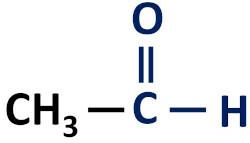
تحدث الألدهيدات دائمًا في نهاية سلاسل الكربون لأن ذرة الكربون تحتاج إلى الارتباط بذرة هيدروجين واحدة على الأقل.
أ تسمية مركبات الألدهيد يتبع قواعد IUPAC ، تختلف حسب اللاحقة. يتم تحديد الألدهيدات بواسطة اللاحقة -آل.
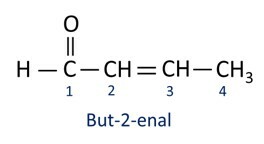
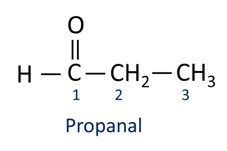
تستخدم الألدهيدات صناعياً في صناعة العطور و توابلحيث تختلف رائحته وطعمه باختلاف طول سلسلة الكربون. تستخدم مركبات الألدهيد أيضًا في صناعة منتجات التنظيف والأدوية والبوليمرات وغيرها. يمكن استخدام الألدهيدات ذات السلسلة الكربونية القصيرة كعامل حفظ ، مثل المشهور الفورمالين، وهو ألدهيد يسمى ميثانال.

حمض الكربوكسيل
يتم تحديد وظيفة حمض الكربوكسيل العضوي من خلال وجود مجموعة الكربوكسيل الوظيفية (-COOH).
المجموعة الوظيفية من الأحماض الكربوكسيلية: - (C = O) OH أو –COOH.

المركبات التي تنتمي إلى هذه الوظيفة العضوية هي أحماض ضعيفة ، لأنها تطلق أيونات H بسهولة+ في محلول مائي.
أ تسمية الأحماض الكربوكسيلية يتبع قواعد Iupac ، ولكن يظهر المصطلح "حمض" قبل البادئة التي تشير إلى رقم الكربون ، واللاحقة المستخدمة هي -oic.
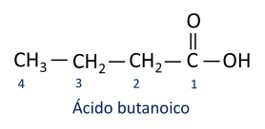
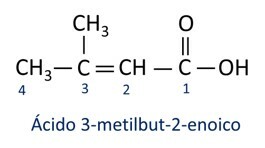
ا حمض الكربوكسيل الأكثر شيوعًا في الحياة اليومية هو حمض الاسيتيك، مادة موجودة في الخل. فيتامين ج ، المتوفر في العديد من ثمار الحمضيات ، هو جزيء عضوي يسمى حمض الأسكوربيك.
استر
وظيفة استر العضوي يتم التعرف عليه من خلال وجود مجموعة كاربونيل الوظيفية ، التي تحتوي ذرة الكربون على رابطة أكسجين.
المجموعة الوظيفية للإسترات: –R– (C = O) O – R '.
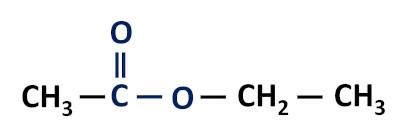
الإسترات مشتقات الأحماض الكربوكسيلية، تختلف عن هؤلاء في أن لديهم جذور ألكيل مرتبطة بذرة الأكسجين بدلاً من ذرة الهيدروجين.
تتشكل الجزيئات التي تنتمي إلى وظيفة الإستر عن طريق التفاعل بين حمض الكربوكسيل والكحول ، وهو تفاعل يعرف باسم الأسترة.
قواعد تسمية الاسترات حسب تعريف Iupac ، اعتبر أن الجزيء يتكون من جزأين:
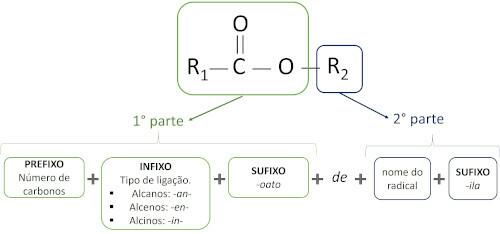
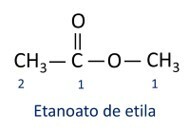
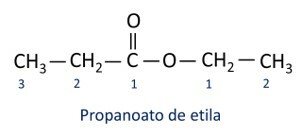
السمة الرئيسية للاسترات هي القدرة على محاكاة الطعم والرائحة من الأطعمة الطبيعية حسب طول سلاسل الكربون (R1 و ر2). لهذا السبب ، تُستخدم الإسترات على نطاق واسع كعوامل منكهة في صناعة الأغذية ، في إنتاج الأدوية والعطور ومستحضرات التجميل.
الأثير
وظيفة الأثير العضوية هي تتميز بوجود ذرة أكسجين بين سلسلتي كربون.
المجموعة الوظيفية للإيثرات: R – O – R.

الإيثرات هي مواد شديدة الاشتعال ولها رائحة مميزة وقوية.
أ تسميات Iupac الرسمية للإيثرات يتبع بادئة الطلب + infix + لاحقة. ومع ذلك ، فإن جانب الجزيء الذي يحتوي على عدد أقل من الكربون يُعطى لاحقة -وكسي بينما يتم تسمية سلسلة الكربون الأطول كما لو كانت هيدروكربون ، وتستقبل اللاحقة -o.
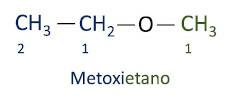
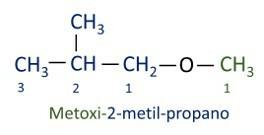
الاثيرات تستخدم كمذيبات للدهانات والراتنجات والزيوت والدهون. نتيجة لذلك ، يتم استخدامها في عمليات صناعية وصيدلانية مختلفة. تم استخدام الأثير مرة واحدة كمخدر ، حيث تم استبداله بمواد أخرى أكثر أمانًا هذه الأيام.
اقرأ أيضا:مركبات النيترو - المركبات التي تحتوي على مجموعات نيترو (NO2) في جزيءها
تمارين حلها على وظائف الأكسجين
السؤال رقم 1
(Uece) في الكيمياء العضوية ، تُعرَّف المجموعة الوظيفية على أنها بنية جزيئية تعطي المواد سلوكًا كيميائيًا مشابهًا. تسمى مجموعة المركبات التي لها نفس المجموعة الوظيفية الوظيفة العضوية. حدد الخيار الذي يقدم بشكل صحيح المركب والوظيفة العضوية التي ينتمي إليها.

دقة:
الحرف ج
من بين البدائل ، البديل الوحيد الذي يعبر بشكل صحيح عن المجموعة الوظيفية لاسم الوظيفة الكيميائية هو البند ج. يتم تحديد وظيفة الإستر العضوي من خلال مجموعة الكربونيل الوظيفية ، والتي تحتوي ذرة الكربون أيضًا على رابطة أكسجين.
في البند أ ، يتم التعبير عن مجموعة الأثير الوظيفية.
في البند ب ، يتم التعبير عن المجموعة الوظيفية للكيتون.
في البند D ، يتم التعبير عن مجموعة amide الوظيفية. الأمينات إنها أميدات تنتمي إلى وظائف النيتروجين.
السؤال 2
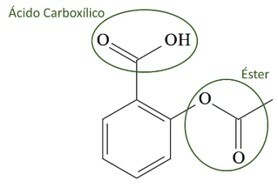
(UCS-RS) في القرن الخامس قبل الميلاد. كتب الطبيب اليوناني ، أبقراط ، أن منتج لحاء الصفصاف يخفف الألم ويخفض الحمى. هذا المنتج نفسه ، مسحوق حامض ، ورد ذكره حتى في نصوص الحضارات القديمة في الشرق الأوسط وسومر ومصر وآشور. استخدمه الأمريكيون الأصليون أيضًا ضد الصداع والحمى والروماتيزم والرعشة. هذا الدواء هو مقدمة للأسبرين ، والذي يظهر التركيب الكيميائي له أدناه.
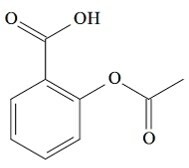
الوظائف العضوية الموجودة في بنية الأسبرين ، المذكورة أعلاه ، هي:
أ) حامض الكربوكسيل والإستر.
ب) الكحول والأثير.
ج) أمين وأميد.
د) الأمين والأثير.
ه) الأحماض الأمينية والكحول.
دقة:
الحرف ا
بقلم آنا لويزا لورينزن ليما
مدرس كيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/funcoes-oxigenadas.htm


