ا الأكتينيوم، الرمز Ac والرقم الذري 89 ، هو عنصر ينتمي إلى كتلة f من الجدول الدوري، ما يسمى بعناصر الانتقال الداخلية. إنه مشابه كيميائيًا اللانثانم (لذلك ، على سبيل المثال ، له شحنة تساوي +3 في المركبات) ، ولكن يصعب الحصول عليه مع القليل من التطبيقات. من بين ما يقرب من 30 نظيرًا لهذا العنصر ، هناك اثنان فقط طبيعيان هما الأكتينيوم 227 والأكتينيوم 228.
من الأفضل الحصول على الأكتينيوم بقصف نوى مذياع (Ra) بالنيوترونات الحرارية ، وهي تقنية تجعل من الممكن تحقيقه في نطاق مليغرام. لا تزال تطبيقاته مقيدة ، لكن من المعروف أنه يمكن استخدامها كمصدر للطاقة للمركبات الفضائية والأجهزة التي تعمل في المناطق النائية ، تمامًا كما يعتبر الأكتينيوم 225 مرشحًا محتملاً لعلاج بعض أنواع السرطان.
اقرأ أيضا:السيزيوم 137 - النظير المشع الذي تسبب في الحادث الإشعاعي في جويانيا
ملخص عن الأكتينيوم
إنه معدن ينتمي إلى كتلة f من الجدول الدوري.
في شكل معدني ، لها لون أبيض فضي ، وأحيانًا مع لمعان ذهبي.
في الحل ، نظرًا لتشابهه مع اللانثانم ، فإن أكاسيد النيتروجين é +3.
يحتوي على حوالي 30 نظيرًا ، اثنان منها فقط موجودان في الطبيعة: الكتلة 227 و 228.
إنه موجود في عينات من اليورانيوم، ولكن يتم الحصول عليها عن طريق قصف النظائر المشعة بالنيوترونات الحرارية.
من الصعب الحصول عليها وقليل من الطلبات.
ومع ذلك ، يبرز دور نظير الأكتينيوم 225 في محاربة بعض أنواع السرطان.
خصائص الأكتينيوم
رمز: ac
العدد الذري: 89
الكتلة الذرية: 227 c.u.
كهرسلبية: 1,1
نقطة الانصهار: 1050 درجة مئوية
نقطة الغليان: 3198 درجة مئوية
كثافة: 10.07 جم سم-3 (محسوب)
التكوين الإلكترونية: [آكانيوز] 7 ث2 6 د1
سلسلة كيميائية: أكتينيدات ، كتلة f ، عناصر انتقالية داخلية
خصائص الأكتينيوم
الأكتينيوم ، العدد الذري 89 والرمز Ac، إنها فلز تنتمي إلى مجموعة الأكتينيد ، الموجودة في كتلة f من الجدول الدوري. في شكله المعدني ، يكون لونه أبيض فضي ، وأحيانًا يكون لونه ذهبي.
كيميائيا ، الأكتينيوم تذكرنا جدًا باللانثانميمكن القول أنه من الناحية النوعية لا توجد فروق بين الاثنين. لذلك ، في المحلول وفي تكوين المركبات ، يحتوي الأكتينيوم على شحنة +3 (Ac3+). عند ملامسته للهواء ، يتأكسد بسرعة ويشكل طبقة AC.2ا3، مما يمنع استمرار أكسدة.
قليل من المركبات المعروفة للأكتينيوم ، من بينها الهاليدات والأوكسي هاليدات والأكسيد والكبريتيد. ومن المتوقع وجود البعض الآخر ، كما هو الحال بالنسبة للكربونات ، ومع ذلك ، لم يتم تحديدها بعد.
من المعروف أن حوالي 30 نظيرًا من الأكتينيوم، كونهما طبيعيان فقط: 227acc 228قبل الميلاد الأول ، الأكثر شهرة ، يأتي من سلسلة الاضمحلال الإشعاعي 235يو ولها وقت نصف الحياة 21.77 سنة. الأكتينيوم -228 ، الذي يبلغ عمر نصفه 6.15 ساعة ، هو نتاج سلسلة الاضمحلال الإشعاعي للثوريوم -232.
اقرأ أيضا:الاضمحلال الإشعاعي - ظاهرة تتحول فيها الذرة إلى نواة جديدة
أين يمكن العثور على الأكتينيوم؟
الأكتينيوم (بشكل أكثر تحديدًا في الشكل 227قبل الميلاد) يعتمد بشكل مباشر على كمية اليورانيوم 235، موزعة بشكل جيد في جميع أنحاء قشرة الأرض. يبلغ متوسط محتوى اليورانيوم في القشرة الأرضية 2.7 جزء في المليون (جزء في المليون ، أو ملجم لكل كجم) ، مع وجود 0.72٪ من الكتلة تعادل 235يو. هذا يجعل من الممكن حساب الوفرة الطبيعية لـ 227Ac (بناءً على عمر النصف لليورانيوم والنظير نفسه) ، والذي سيكون 5.7 × 10-10 جزء في المليون.
الحصول على الأكتينيوم
على الرغم من وجوده في خامات اليورانيوم ، إلا أن الحد الأقصى من الأكتينيوم الذي تم الحصول عليه من هذا المصدر الطبيعي كان حوالي 7 ميكروغرام (ميكروغرام ، 10)-6 جرامات).
جاءت أفضل طريقة للحصول عليها في أواخر الأربعينيات ، عندما تمكن العلماء من الحصول عليها 227قبل الميلاد من خلال تشعيع 226رع بالنيوترونات الحرارية.

باستخدام هذه التقنية ، تم الحصول على كميات مليغرام من Ac.
تطبيقات الأكتينيوم
الطاقة من الجسيمات الخمسة ألفا المتولدة خلال سلسلة الاضمحلال الإشعاعي لـ 227سمح التيار المتردد باستخدامه كملف مصدر الحرارة في المولدات الكهروحرارية بالنظائر المشعة. سيتم إنتاج الطاقة للمركبات الفضائية أو الأجهزة الأخرى التي تحتاج إلى العمل لفترة طويلة في المواقع البعيدة.
بالفعل 225AC ، الذي يبلغ نصف عمره 10 أيام ، هو نظير مشع ينبعث من ألفا مع خصائص مثيرة للتدمير السريع للخلايا السرطانية. الطاقة الكبيرة المنبعثة من تفكك 225AC ، الذي يولد أربعة جسيمات ألفا ، يمكن استخدامها في الجراحة لمهاجمة الأورام السرطانية البروستاتا والثدي ونخاع العظام. نقطة أخرى مثيرة للاهتمام هي أن سلسلة اضمحلال الأكتينيوم 225 تنتهي عند 209ثنائي ، نظير مستقر وغير سام.
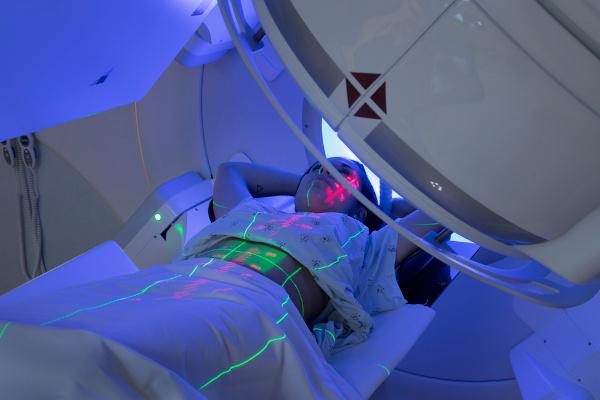
تحديات استخدام 225التيار المتردد في عدم تكوين الآخرين النظائر المشعة، مثل مادة يحتمل أن تكون خطرة 221الأب ، والسماح لنظير الأكتين بالعمل لفترة أطول على هدف الورم.
تاريخ الأكتينيوم
في عام 1899 ، في مختبرات بيير و ماري كوري, ذكر André-Louis Debierne أنه وجد عنصرًا مشعًا جديدًا، والتي ستكون كيميائية قريبة من التيتانيوم. بعد ستة أشهر ، في عام 1900 ، ذهب ديبيرن إلى حد القول إن جزء التيتانيوم لم يعد نشطًا للغاية وأن العنصر الجديد الذي كان يبحث عنه الآن يشبه الثوريوم كيميائيًا.
ادعى ديبيرن اكتشاف العنصر الجديد، وتعميده الأكتينيوم (من اليونانية اكتيس، وهو ما يعني "شعاع"). في ذلك الوقت ، لم يتم انتقاد اكتشاف أندريه لويس ديبيرن ، ولكن بناءً على ما هو معروف اليوم ، من الواضح أن تجارب 1899 لم تكن كذلك. لم ينتج أي أكتينيوم ، بينما أنتجت تجارب القرن العشرين مزيجًا من النويدات المشعة ، بما في ذلك الأكتينيوم على نطاق أصغر.
رغم، في عام 1902 ، أبلغ فريدريك أوسكار جيسيل عن مادة "منبثقة" جديدة (مادة مشعة) من بين شوائب البتشبلند (أحد أشكال خام البتشبلند ، أكسيد اليورانيوم). كان جيزيل قادرًا على تحديد العديد من الخصائص الكيميائية لهذه المادة الجديدة بشكل صحيح ، بما في ذلك الحقيقة المهمة المتمثلة في أنها كانت مشابهة كيميائيًا لمجموعة السيريوم الأرضية النادرة.
في عام 1903 ، تمكن العالم من تركيز العينة إلى درجة وجود اللانثانم فقط كشوائب ، وليس من الممكن اكتشاف الثوريوم. في العام التالي ، قام جيزيل بتعميد العنصر الجديد "إيمانيوم" ، حيث كان من الواضح أنه يواجه عنصرًا جديدًا عنصر الراديو.
هاجم ديبيرن بقوة ادعاءات جيزيل، وأصر على أنها كانت نفس المادة التي اكتشفها وأطلق عليها اسم الأكتينيوم ، على الرغم من أنه هو نفسه ذكر أنها كانت مشابهة كيميائيًا للتيتانيوم والثوريوم.
في وقت لاحق ، ساد ديبيرن ، مما جعل العديد من المؤرخين يضعونه باعتباره المكتشف الحقيقي للعنصر 89 ، ولكن ربما بسبب تأثير الزوجين كوري وحقيقة ذلك رذرفورد أعطاك الاعتمادات. لكن البعض الآخر يفضل تقسيم الائتمان بين ديبيرن وجيزيل.
ال كان اكتشاف الأكتينيوم أيضًا استمرارًا لعمل كوري، ولكن لم يكن له نفس تأثير الراديوم المكتشف حديثًا (Ra). على عكس الراديوم ، في ذلك الوقت ، لم يكن للأكتينيوم أي تطبيق ، بالإضافة إلى كونه نادرًا للغاية في الطبيعة ويصعب الحصول عليه.
بقلم ستيفانو أروجو نوفايس
مدرس كيمياء

