ال نيهونيوم, العدد الذري 113 والرمز Nh ، هو عنصر كيميائي ينتمي إلى المجموعة 13 من الجدول الدوري. بالإضافة إلى ذلك ، فهو عنصر ثقيل للغاية غير موجود في الطبيعة. وبالتالي ، لا يمكن الحصول عليها إلا بشكل مصطنع ، من خلال تفاعلات الاندماج النووي. لا تزال الخصائص الكيميائية للنيهونيوم غير واضحة تمامًا ، ولكن يُعتقد أنه يتصرف بشكل مشابه لنظيره الأخف ، الثاليوم ، في بعض الحالات.
تم الحصول على النيهونيوم في البداية عن طريق الذوبان 70Zn مع 209Bi ، في معهد Riken ، اليابان ، في عام 2003. على الرغم من أن العلماء الروس والأمريكيين طلبوا أيضًا الاعتراف بهم كمكتشفين للعنصر 113 ، إلا أن IUPAC اعترفت بالعلماء اليابانيين. يشير الاسم إلى كلمة نيهون ، كما يسمي اليابانيون بلدهم الأصلي.
اقرأ أيضا: الغاليوم - عنصر كيميائي آخر ينتمي إلى المجموعة 13 من الجدول الدوري
ملخص حول النيهونيوم
إنه عنصر كيميائي اصطناعي يقع في المجموعة 13 من الجدول الدوري.
بدأ إنتاجه في عام 2003 ، في معهد Riken ، اليابان.
وهي تشكل مجموعة العناصر التي تم تضمينها مؤخرًا في الجدول الدوري ، في عام 2015.
لا تزال دراساته حديثة جدًا ، لكن البعض يسعى إلى ربطها بعناصر أخرى من المجموعة 13 ، مثل الثاليوم.
إنتاجه الاندماج النوويباستخدام نظائر 70الزنك وذرات 209ثنائية.
خصائص النيهونيوم
رمز: ناه
العدد الذري: 113
الكتلة الذرية: بين 278 و 286 cu (غير رسمي بواسطة Iupac)
التكوين الإلكترونية: [آكانيوز] 7s2 5f14 6 د10 7 ص1
أكثر النظائر استقرارًا:286Nh (9.5 ثوانٍ من نصف الحياة، والتي يمكن أن تزيد بمقدار 6.3 ثوانٍ أو تنقص بمقدار 2.7 ثانية)
سلسلة كيميائية: المجموعة 13 ، عناصر ثقيلة للغاية
خصائص النيهونيوم
Nihonium ، الرمز Nh والعدد الذري 113 ، كان أحد العناصر الأخيرة المدرجة في الجدول الدوري. تم اعتمادها في 30 ديسمبر 2015 ، من قبل الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) ، في حين تم جعل اسمها رسميًا فقط في منتصف عام 2016.
العناصر في هذه المنطقة من الجدول الدوري غير مستقرة للغاية ، مما يعني أنه لا يمكن العثور عليها في الطبيعة. وبالتالي ، في مواجهة الوجود المزعوم ، سوف يخضعون للاضمحلال الإشعاعي على الفور تقريبًا - انبعاث الجسيمات النووية ، مثل α و - من أجل تحقيق قدر أكبر من الاستقرار.
ومع ذلك ، عندما تنبعث منها جزيئات نووية ، ينتهي بها الأمر بالتحول النووي ، أي أنها تصبح عنصرًا كيميائيًا جديدًا. وبالتالي ، يجب إنتاج العناصر فائقة الثقل ، مثل NH ، في المختبر ، مما يجعلها عنصر كيميائي اصطناعي.
Nh ، مثل العناصر الثقيلة الأخرى ، يتأثر بـ التأثيرات النسبية - بطريقة بسيطة ، المسافات من ما يتم ملاحظته إلى ما كان متوقعًا ، بسبب النسبية. وهكذا ، أشارت الدراسات الرياضية في المجال النظري ، والتي تحاكي نتائج التأثير النسبي ، إلى أن النيهونيوم يمكن أن تتفاعل بشكل ضعيف مع الكوارتز ، ولكن امتلاك الامتزاز الجيد ل ذهب، مثل نظيره الأخف ، الثاليوم (تل).
كما أشارت الدراسات النظرية الأولية إلى التقلب من NH. بالنسبة لامتصاص الكوارتز ، فإن الثاليوم يشكل بسهولة TlOH ، على سبيل المثال ، ويشتبه في أن النيهونيوم يفعل الشيء نفسه.
ومع ذلك ، كيف لا تزال الدراسات أولية وحديثة للغاية، الكثير مما تم إنتاجه مفتوح للنقاش ، ومن الصعب التحديد الدقيق للخصائص الفيزيائية والكيميائية للنيهونيوم.
الحصول على النيهونيوم
تم الحصول على العنصر 113 ، حتى اليوم ، بطريقتين: من خلال تفاعلات الانصهار البارد، مع اندماج الزنك (Zn، Z = 30) بالبزموت (Bi، Z = 83) وأيضًا من خلال تسوس ألفا للعنصر 115.
في المثال الأول ، ملف الزنك يتم تسريعها إلى 10٪ من سرعة الضوء، من أجل التغلب على قوى التنافر للنواتين. ثم يتم إنتاج نظير 279Nh ، والذي ينتهي بإصدار نيوترون وإنتاج 278لا.

مع نصف عمر حوالي 34 مللي ثانية ، النظير 278NH يخضع لستة تحلل ألفا (انبعاثات جسيمات ألفا) إلى عنصر مندليفيوم (Md).
في الحالة الثانية ، ينشأ العنصر 113 من تحلل ألفا للعنصر 115 (المعروف الآن باسم موسكوفيوم) بعد تصنيعه. طريقة واحدة هي تفاعل الاندماج الساخن للأيونات 48Ca مع النظائر 243آه ، إنتاج 288مولودية ثم ، من خلال تسوس ألفا ، 284NH ، والتي تستمر في الخضوع لاضمحلال ألفا.
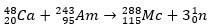
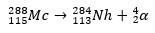
نرى أيضا: الهاسيوم - أثقل عنصر كيميائي اصطناعي يتم تحليل خصائصه
تاريخ النيهونيوم
بدأت عمليات البحث عن العنصر 113 في عام 2003. قام باحثون يابانيون في معهد Riken بتسريع نظائر 70Zn بنسبة 10٪ من سرعة الضوء لكي يتصادم مع 209ثنائية ، من خلال تفاعل الاندماج. وهكذا ، تمكنوا من إنتاج ما نعرفه الآن 278لا.
ومع ذلك ، كان ذلك فقط في عام 2012 تمكن الباحثون اليابانيون من اكتشاف سلسلة اضمحلال ألفا الكاملة من العنصر 113 ، الاتصال بـ IUPAC للمطالبة بالاكتشاف.
بالتزامن مع الجهود اليابانية ، قام العلماء الروس بقيادة يوري أوجانيسيان ، بالتعاون مع توصل العلماء الأمريكيون أيضًا إلى تحديد العنصر 113 من خلال تحلل ألفا للعنصر 115. مثل هذه التجارب وضعت العلماء الروس والأمريكيين في تنافس على التعرف على العنصر 113.

ومع ذلك ، وجدت IUPAC أن الأدلة من معهد Riken أكثر صلابة ، وبالتالي سمحت لليابانيين بالحق في تسمية العنصر 113. كان الاسم المختار nihônio ، الرمز Nh ، في إشارة إلى البلد اليابان. كلمة اليابان كتبها اليابانيون باستخدام حرفين صينيين يعنيان "أرض الشمس المشرقة" ويُقرأان باسم نيهون أو نيبون.
تم اختيار اسم nihonium أيضًا لأنه في عام 1908 نشر الكيميائي الياباني Masataka Ogawa ما يلي: اكتشف العنصر 43 ، وسمته باليابانية ، والرمز Np (والذي ينتمي اليوم إلى النبتونيوم ، Z = 93). ومع ذلك ، في وقت لاحق ، ثبت أن العنصر 43 كان غير مستقر ، ولم يتم العثور عليه في الطبيعة وتم تصنيعه فقط في عام 1937 ، وحصل على اسم التكنيشيوم (ح).
وهكذا ، اختفى اليابانيون من الجدول الدوري. ومع ذلك ، بعد سنوات ، ثبت أن أوجاوا اكتشف العنصر 75 (المعروف الآن باسم الرينيوم). ومع ذلك ، بحلول ذلك الوقت ، تم اكتشاف عنصر الرينيوم رسميًا بالفعل في عام 1925 وتم تعميده.
تمارين حلها على النيهونيوم
السؤال رقم 1
Nihonium ، الرمز Nh والرقم الذري 113 ، هو عنصر كيميائي لا يمكن العثور عليه في الطبيعة بسبب قصر عمره النصفي. الأكثر ديمومة منهم ، و 286Nh ، حوالي 9.5 ثانية. مع العلم أن نصف العمر هو الوقت اللازم لانخفاض كمية الأنواع بمقدار النصف ، كم ثانية يستغرقها مقدار النظير أعلاه ليكون 1/16 من المقدار مبدئي؟
أ) 9.5
ب) 19
ج) 28.5
د) 38
هـ) 47.5
دقة:
البديل د
كل 9.5 ثانية ، تنخفض كمية النظير بمقدار النصف. لذلك ، بعد 9.5 ثانية ، يكون مقدارها نصف الكمية الأولية. 9.5 ثانية أخرى ، بإجمالي 19 ثانية ، ينخفض المقدار بمقدار النصف مرة أخرى ، ليصل إلى 1/4 من الأولي.
عند 28.5 ثانية ، بعد فترة نصف عمر أخرى ، تنخفض الكمية بمقدار النصف مرة أخرى ، لتصل إلى 1/8 من المقدار الأولي. أخيرًا ، بعد 38 ثانية ، ينخفض المبلغ بمقدار النصف مرة أخرى ، ليصل إلى 1/16 من المبلغ الأولي ، كما هو مطلوب في الكشف. وبالتالي ، فإن الوقت المطلوب هو 38 ثانية.
السؤال 2
في عام 2003 ، بدأ البحث عن العنصر 113 في معهد Riken في اليابان. في ذلك الوقت ، كان العلماء قادرين على إنتاج ملف 278NH من خلال اندماج ذرات الزنك والبزموت.
كم عدد النيوترونات في النظير المقتبس؟
أ) 113
ب) 278
ج) 391
د) 170
هـ) 165
دقة:
البديل ه
عدد ال النيوترونات يمكن حسابها على النحو التالي:
أ = ع + ن
حيث A هو عدد معكرونة الذري، Z هو العدد الذري و n هو عدد النيوترونات. باستبدال القيم ، لدينا:
278 = 113 + ن
ن = 278-113
ن = 165
بقلم ستيفانو أروجو نوفايس
مدرس كيمياء
