ال كروم, العدد الذري 24 ، هو معدن انتقالي يقع في المجموعة 6 من الجدول الدوري. لونه رمادي ، لكنه أيضًا معدن لامع جدًا. يوجد بشكل أساسي في حالات الأكسدة +2 و +3 و +6 وله خاصية أن جميع مركباته ملونة. لا عجب أن اسمها مشتق من اليونانية صفاء، وهو ما يعني اللون.
يتم الحصول على هذا العنصر من خلال الكروميت ويستخدم على نطاق واسع في صناعة المعادن ، في إنتاج الفولاذ المقاوم للصدأ والسبائك الخاصة الأخرى. يمكن أيضًا طلاء الكروم بالكهرباء على الأشياء ، في تأثير يُعرف باسم طلاء الكروم ، والذي يضمن ، بالإضافة إلى الجمال ، مقاومة كيميائية كبيرة. تستخدم مركبات الكروم أيضًا في الأصباغ والدهانات ، بالإضافة إلى المواد المقاومة للحرارة.
اقرأ أيضا: الهافنيوم - معدن انتقالي له خصائص مشابهة للزركونيوم
ملخص الكروم
الكروم معدن لامع رمادي اللون يفتح المجموعة 6 من الجدول الدوري.
إنه مقاوم للغاية للتآكل والهجوم الكيميائي في درجة حرارة الغرفة.
يعرض بشكل أساسي حالات الأكسدة +2 و +3 و +6.
كل مركباتها لها ألوان.
يمكن الحصول عليها من الكروميت ، FeCr2ال4.
يتم استغلاله بشكل رئيسي من قبل الصناعة المعدنية ، التي تستخدمه في تصنيع الفولاذ المقاوم للصدأ.
اكتشفه الفرنسي لويس نيكولا فوكلين عام 1797.
[pullicity_omnia]
خصائص الكروم
رمز: سجل تجاري.
العدد الذري: 24.
الكتلة الذرية: 51.9961 c.u.s.
كهرسلبية: 1,66.
نقطة الانصهار: 1907 درجة مئوية.
نقطة الغليان: 2671 درجة مئوية.
كثافة: 7.15 جرام سم-3 (عند 20 درجة مئوية).
التكوين الإلكترونية: [الهواء] 4s1 ثلاثي الأبعاد5.
سلسلة كيميائية: المجموعة 6 مإتيس انتقال.
خصائص الكروم
الكروم ، العدد الذري 24 ، هو أ فلز رمادي اللون ، صلب ولامع. في درجة حرارة الغرفة ، يقاوم جيدًا الهجمات الكيميائية ، مثل من المحاليل الحمضية أو الأساسية ، باستثناء حمض الهيدروكلوريك و H2فقط4 مخفف. ومع ذلك ، في درجات الحرارة المرتفعة ، يصبح الكروم أكثر تفاعلًا ، حيث يتأكسد بسهولة بواسطة O2، ويتحد مع الهالوجينات ومعظم اللافلزات.
في المحلول ، تميل مركبات الكروم إلى الحصول على أعداد أكسدة +6 و +3 و +2. في الواقع ، ميزة مثيرة للاهتمام هي ذلك الكل مركبات الكروم ملونة، مثل ثنائي كرومات البوتاسيوم، ك2سجل تجاري2ال7، وهو برتقالي ، وكرومات البوتاسيوم ، ك2CrO4، وهو أصفر.
حقيقة غريبة عن الكروم هي ذلك تكوين الإلكترون الخاص به لا يتبع النمط المتوقع. جعل الخاص بك التوزيع الإلكتروني، من المتوقع أن يكون [Ar] 4s2 ثلاثي الأبعاد4، ومع ذلك ، تظهر حسابات الطاقة والاستقرار أن تكوين [Ar] 4s1 ثلاثي الأبعاد5 إنه أكثر استقرارًا. يمكن تفسير ذلك من خلال حكم هوند.
وفقًا لهذه القاعدة ، كلما زاد عدد الإلكترونات مع يدور متساوية (أو متوازية) في مدار غير مكتمل ، كلما انخفضت طاقة ذرة، أي كلما زاد الاستقرار. انظروا إلى الصورة أدناه:
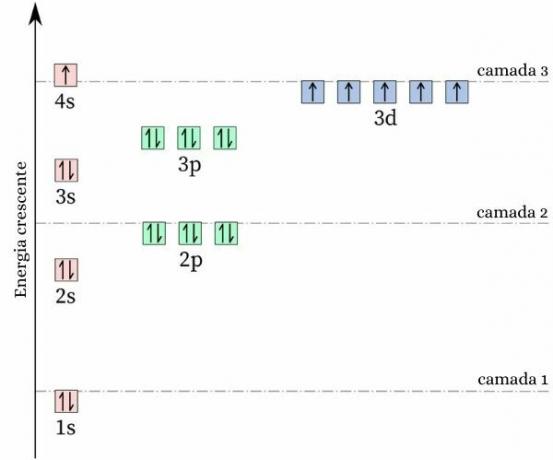
إذا اعتمد الكروم تكوين 4s2 ثلاثي الأبعاد4، المدار 4s سيقدم إلكترونات ذات دوران معاكس (↑ ↓) ، مما سيزيد من التنافر ، بعد كل شيء ، سيكون هناك شحنتان من نفس العلامة تشتركان في مدار واحد.
من خلال اعتماد تكوين 4s1 ثلاثي الأبعاد5, يحتوي الكروم على عدد أكبر من الإلكترونات ذات دوران متساوٍ، دون وجود إلكترونات تشترك في نفس المدار (كما هو موضح في الصورة السابقة) ، مما يقلل من طاقته ويضمن المزيد من الاستقرار.
نرى أيضا: الفاناديوم - عنصر كيميائي لها ألوان مختلفة أيضًا
أين يمكن العثور على الكروم؟
الكروم هو العاشر الأكثر وفرة على وجه الأرض. على الرغم من وجود العديد من المعادن التي تحتوي على الكروم في تكوينها ، الكروميت ، FeCr2ال4، هو أهم معدن من الكروم ، كونه أكثر المعادن التي يتم استغلالها تجاريًا على نطاق واسع.

من المهم إبراز أن ملف البلدان التي لديها أعلى احتياطي من الكروم نكون:
جنوب أفريقيا;
كازاخستان;
الهند;
ديك رومى.
ال البرازيل هي منتج الكروم الوحيد في القارة الأمريكية بأكملهالكنها تمتلك 0.11٪ فقط من احتياطيات العالم. يتم توزيع الاحتياطيات بشكل رئيسي في الولايات التالية:
باهيا;
أمابا;
ميناس جيرايس.
الحصول على الكروم

ال يتم إنتاج الكروم المعدني عبر من الكروميت. في هذه الحالة ، يتم إذابة المعدن كربونات الصوديوم، في2كو3في وجود الهواء ينتج كرومات الصوديوم وأكسيد الحديد الثالث:
4 FeCr2ال4 + 8 بوصة2كو3 + 7 س2 → 8 بوصة2CrO4 + 2 Fe2ال3 + 8 كو2
من هناك ، يتم الاستخراج باستخدام ماء، منذ نا2CrO4 قابل للذوبان في الماء ، بينما الحديد2ال3 ليس. بعد ذلك ، يتم تحمض الوسط بـ H2فقط4، والذي يسمح ببلورة كرومات صوديوم. ثم2CrO4 يتحول إلى أكسيد الكروم الثالث باستخدام كربون عند درجة حرارة عالية:
في2CrO4 + 2 ج → كر2ال3 + تشغيل2كو3 + شركة
يتم الحصول على الكروم المعدني بعد ذلك عند استخدام الألومنيوم كعامل اختزال ، وكذلك عند درجة حرارة عالية:
سجل تجاري2ال3 + 2 Al → Al2ال3 + 2 س
تطبيقات الكروم
ال صناعة المعدنية هو المستهلك الرئيسي للكروم ، حيث ينتج حوالي 80٪ من كل الكروم ، إما على شكل كروميت أو مركز الكروم.2ال3. هذا لأن الكروم قادر على تشكيل سبيكة الحديد ، المصدر الأساسي للحصول عليها الفولاذ المقاوم للصدأ وسبائك خاصة أخرى.
الكروم ، الذي يشكل عادة 18٪ من الفولاذ المقاوم للصدأ ، يزيد بشكل كبير من مقاومة الأكسدة (التآكل) والهجمات الكيميائية الأخرى على الفولاذ. في السبائك الخاصة الأخرى ، يلعب الكروم أيضًا دورًا في زيادة صلابة وصلابة ومتانة المواد.

ال صناعة حرارية كما أنه مستهلك جيد للكروم ، حيث أن الكروميت مادة حرارية معروفة ، أي مادة قادرة على تحمل التأثيرات الحرارية والكيميائية والفيزيائية التي تحدث في الصناعات. الكروميت ، المستخدم في صناعة الطوب الحراري ، مقاوم للغاية للتحلل عند تعرضه للتسخين.
بالفعل صناعة كيميائية يسعى لاستخدام الكروم بعدة طرق:
كمحفز
كمثبط للتآكل ؛
في طلاء الكروم
في أصباغ
في مركبات الصباغة.
طلاء الكروم معروف جيدًا ، ويتكون من تكوين طبقة واقية من الكروم فوق جسم ما ، مما يحميه من التآكل. في هذه العملية ، يتم ترسيب الكروم على الجسم المراد تطعيمه بالكروم التحليل الكهربائي كبريتات الكروم الثالث ، كر2(فقط4)3، الناتجة عن تفكك Cr2ال3 في H.2فقط4.
أصباغ الكروم شائعة جدًا ، خاصة مع الألوان المختلفة التي يمكن الحصول عليها من مركباتها. في تفكك الكروم الثالث كلوريد سداسي هيدرات ، CrCl3·6 صباحا2O ، يتم الحصول على محلول بنفسجي. من ناحية أخرى ، في انحلال كبريتات الكروم الثالث ، Cr2(فقط4)3، يتم الحصول على اللون الأخضر.
محلول كلوريد الكروم الثاني ، CrCl2، أزرق ، بينما خلات الكروم الثاني ، Cr2(سجع)4، مادة صلبة حمراء. أكسيد الكروم الثاني ، CrO2، إنه أسود؛ كرومات البوتاسيوم ، ك2CrO4، والأصفر. ثنائي كرومات البوتاسيوم ، ك2سجل تجاري2ال7والبرتقالي ثلاثي كرومات البوتاسيوم ، ك2سجل تجاري3ال10، إنه أحمر؛ وأكسيد الكروم السادس CrO3، هو أيضا أحمر.
مثير للاهتمام:الياقوت هو في الواقع أحجار كريمة ، من الصيغة Al2ال3، والتي تحتوي على آثار من الكروم في دستورها. هذا هو الحال أيضًا مع الزمرد ، وهو شكل من أشكال البيريل ، الذي ينتج لونه الأخضر عن كميات صغيرة من الكروم.
ايضا اعلم:التنغستن - معدن رمادي اللون يشبه الفولاذ
علاقة الكروم بالصحة
حالتان من الأكسدة للكروم لها دور بيولوجي. لنرى بعد ذلك.
→ الكروم سداسي التكافؤ (Cr6+)
فيما يتعلق Cr6+، من المعروف أنه يمكن أن يكون تعتبر مسرطنة، خاصة إذا تم استنشاقه أو تناوله بكميات كبيرة.
→ الكروم ثلاثي التكافؤ (Cr3+)
لطالما كان الكروم ثلاثي التكافؤ اعتبر عنصر أساسي. أصبحت المكملات الغذائية للكروم في هذا الشكل شائعة لتعزيز العناصر النزرة الأساسية وكعامل لفقدان الوزن. هناك أيضًا نقاش مفاده أن إعطاء الكروم ثلاثي التكافؤ سيكون مثيرًا للاهتمام لعلاجه داء السكري من النوع 2وكذلك سكري الحمل.
برغم من، وضع بعض المؤلفين هذه الضرورة قيد المناقشة. الفكرة السائدة هي أن الكروم ، سواء أكان مكملًا أم لا ، لا فرق في تكوين الجسم ، التمثيل الغذائي يعطي الجلوكوز أو حساسية الأنسولين. يُعتقد ، في الواقع ، أن أعلى جرعة من الكروم لها تأثيرات دوائية وغير غذائية للإشارة إليها كعنصر أساسي.
تاريخ الكروم
يأتي اسم الكروم من اليونانية صفاء، وهو ما يعني اللون. بعد أن أعطيت أيضًا اسمًا لهذا العنصر ، جاء اكتشافهالصيدلاني والكيميائي الفرنسي Louis Nicolas Vauquelin، في عام 1797 ، عندما لاحظ الكروم عند دراسة خام الكروكويت ، PbCrO4. ومع ذلك ، في البداية ، لم يكن المعدن نجاحًا تجاريًا كبيرًا.
بعد خمسة عشر عامًا من اكتشافه ، على سبيل المثال ، لم يكن السير همفري ديفي يعرف الكثير عن الكروم ومركباته عندما كتب كتابه الشهير عناصر الفلسفة الكيميائية، مما يشير فقط إلى أن حامض الكروميك له طعم حامض.
في نفس العام ، كتب Jöns Jacob Berzelius أن مذاق حامض الكروميك السام كان مزعجًا ومعدنيًا. أدرك Berzelius أن المعدن ، على الرغم من هشاشته ، كان مقاومًا تمامًا لتأثير الأحماض والهواء الجوي.
على الرغم من أنه لم يكن في البداية نجاحًا تجاريًا كبيرًا ، في نهاية القرن التاسع عشر وبداية القرن العشرين ، العنصر بدأ استخدامه تجاريًا، حيث بدأ استخدام الفولاذ المقاوم للصدأ على نطاق واسع ، وكذلك طلاء الأجزاء بالكروم في صناعة السيارات ، مما جعل الكروم معدنًا مطلوبًا بشكل كبير.
تمارين حل الكروم
السؤال رقم 1
(UEFS / BA)تحتوي ذرة الكروم على عدد أكسدة +3 في الأنواع
أ) كر2ال3
ب) CrO
ج) كر
د) CrO42-
ه) كر2ال72-
دقة:
البديل أ
في الحرف C ، يظهر الكروم كمادة بسيطة ، لذلك ، في هذه الحالة ، يظهر الكروم أكاسيد النيتروجين يساوي الصفر.
ال الأكسجين في المركبات الأخرى يحدث مع أكاسيد النيتروجين يساوي -2. وبالتالي ، يمكننا حساب أكاسيد النيتروجين للكروم في جميع الأنواع ، مما يجعله المجهول (x):
سجل تجاري2ال3 → 2x + 3 (-2) = 0 ⸫ x = +3
CrO → x + (-2) = 0 ⸫ x = +2
CrO42- → س + 4 (-2) = -2 ⸫ س = +6
Cr2O72- → 2 س + 7 (-2) = -2 ⸫ س = +6
السؤال 2
(UPE 2013) اكتشفت مجموعة دولية من العلماء تفاعلًا كيميائيًا معقدًا مسؤولاً عن تدهور بعض من أعمال فنية عظيمة في التاريخ أنتجها فنسنت فان جوخ (1853-1890) وغيره من الرسامين المشهورين في القرن العشرين التاسع عشر. في تحقيقاتهم ، قام هؤلاء الباحثون بعمر الأصباغ بشكل مصطنع ووجدوا أن ارتبط سواد الطبقة العليا بتغير الكروم الموجود في الطلاء من Cr (VI) إلى كر (الثالث).
متوفر في: http://agencia.fapesp.br/13455 (تكيف)
البيانات:Cr (Z = 24) ، التكوين الإلكتروني: [Ar] 4s1 ثلاثي الأبعاد5
في ضوء الوضع الموصوف أعلاه ، فهو كذلك صيحأكد أن (ال)
أ) أدت أكسدة Cr (VI) إلى Cr (III) إلى تدهور الأعمال الفنية العظيمة في التاريخ.
ب) يرتبط تقادم الإطارات بالإثارة الإلكترونية للنحاسال ل Cr3+.
ج) عملية تخفيض الكروم6+ ل Cr3+ حجب الأعمال الشهيرة في القرن التاسع عشر.
د) أدى التحول الذي حدث إلى أكسدة النحاسالمسؤول عن تألق اللوحة الأصلية.
هـ) التغيير من Cr (VI) إلى Cr (III) هو تفاعل كيميائي يحدث فقط بعد سنوات عديدة.
دقة:
البديل ج
الانتقال من Cr (VI) إلى Cr (III) هو عملية اختزال (انخفاض في أكاسيد النيتروجين) ، وهو المسؤول عن تعتيم الشاشات.
بقلم ستيفانو أروجو نوفايس
مدرس كيمياء
