ال الفرانسيوم، الرمز Fr ، العدد الذري 87 ، هو عنصر ينتمي إلى المجموعة 1 من الجدول الدوري، الفلزات القلوية. ومع ذلك ، على عكس العناصر الأخرى في المجموعة ، لا يحتوي الفرانسيوم على نظائر مستقرة ، مما جعل اكتشافه صعبًا. في الواقع ، كان francium العنصر الأخير الذي سيتم اكتشافه ومعزولة في عينات طبيعية.
لا يسمح عدم استقراره الذري الكبير بالحصول على عينات مرئية وثقيلة ، لذلك يتم استقراء خصائصه الفيزيائية والكيميائية من بيانات المعادن القلوية الأخرى. تشير التقديرات إلى أنه لا يوجد سوى 30 جرامًا من الفرانسيوم في القشرة الأرضية ، مما يجعلها ثاني أندر عنصر على هذا الكوكب، فقط خلف الأستاتين.
اقرأ أيضا: الروبيديوم - عنصر يستخدم في صناعة النظارات الخاصة والساعات الذرية
ملخص الفرانسيوم
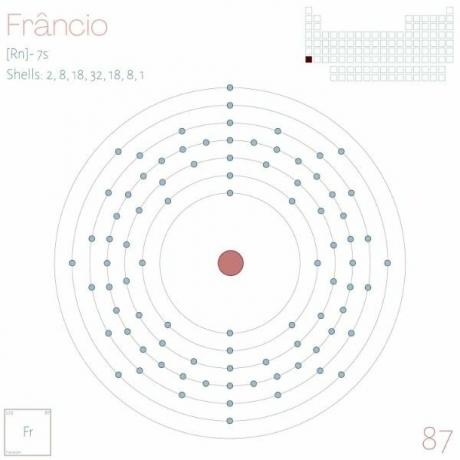
الفرانسيوم معدن قلوي يقع في الفترة السابعة من الجدول الدوري ، الرمز Fr ، Z = 87.
لا يحتوي على نظائر مستقرة وهو ثاني أندر عنصر على هذا الكوكب.
أكثر نظائره استقرارًا له وقت نصف الحياة 22 دقيقة.
إنه العنصر ذو الأعظم شعاع ذري من الجدول الدوري ، بالإضافة إلى كونه الأكثر حساسية للكهرباء.
لا يمكن الحصول عليها إلا من خلال العمليات النووية ، حيث يصعب عزلها.
لا توجد حتى الآن تطبيقات عملية متعلقة بالفرانسيوم.
خصائص الفرانسيوم
رمز: الاب.
الكتلة الذرية: 223.02 ش.
نقطة الانصهار: 22 درجة مئوية (مقدرة).
نقطة الغليان: 665 درجة مئوية (تقديرية).
كثافة: 2.5 جم / سم مكعب (تقديري).
كهرسلبية: 0,79.
التوزيع الإلكتروني: [آكانيوز] 7 ث1.
→ درس فيديو عن الخصائص الدورية وغير الدورية للعناصر الكيميائية
خصائص الفرانسيوم
الفرانسيوم له عدة نظائر، ولكن النظير 233 هو الأكثر استقرارًا ، حيث يصل عمر النصف إلى 22 دقيقة. فقط النظير 212 له عمر نصف مماثل يبلغ 21 دقيقة ، بينما لا يقترب الآخرون من ذلك ، بل قد يكون لديهم نصف عمر في حدود الثواني.

كل هذا عدم الاستقرار الذري يعيق تحديد الخصائص والخصائص الفيزيائية المهمة. في الواقع ، تم الحصول على الخصائص المعروفة في ظل ظروف قاسية. تخفيف (تركيز من أجل 10-15 مول / لتر).
كمعدن قلوي ، من المعروف أن رقم الأكسدة الخاص به هو +1. أظهرت التجارب أيضًا أن الفرانسيوم هو أكبر عنصر موجب للكهرباء من الجدول الدوري. موضع قيادي آخر لهذا العنصر في الجدول هو أكبر قطر يبلغ 2.7 أنجستروم (10-10 م).
مثل المعادن القلوية الأخرى ، يظل الفرانسيوم في محلول بينما تترسب العناصر الأخرى في شكل هيدروكسيدات ، كربونات ، فلوريد ، كبريتيد ، كرومات ، إلخ.
اقرأ أيضا: ما هي العناصر المشعة؟
الحصول على الفرانسيوم
كان الفرانسيوم -223 ، أكثر نظائر الأب ثباتًا تم اكتشافه لأول مرة من خلال انبعاث ألفا من الأكتين 227. من الممكن أيضًا إنتاج الفرانسيوم (النظير 212) عن طريق القصف ذهب (197Au) مع الأكسجين 18 (18س) في مفاعل نووي.
يمكن الحصول على الفرانتيوم بعدة طرق. فمثلا، هناك إمكانية تعجيلها مع سيزيوم، عبر أملاح عناصر قليلة الذوبان مثل البركلورات (ClO4-) ، سداسي كلورو بلاتينات (PtCl62-) ، يودات (IO4-)، بين الاخرين. ومع ذلك ، من المتوقع أن يكون فصل السيزيوم والفرانسيوم صعبًا للغاية.
سمحت الطرق الأخرى التي تم تطويرها في الستينيات والسبعينيات من القرن الماضي بـ فصل الفرانسيوم عن محاليل السيزيوم والروبيديوم من خلال راتنجات التبادل الكاتيوني. يمكن أيضًا فصل Frantium-223 ، الذي تم اكتشافه من انبعاث ألفا من الأكتينيوم 227 ، عن الأكتينيوم ومنتجات التفكك الأخرى عن طريق تقنيات الترسيب الانتقائي. هناك أيضًا تقنية أخرى مستخدمة بنجاح نسبي: تسامي كلوريد الفرانسيوم (FrCl) عند درجات حرارة حوالي 300 درجة مئوية.
تطبيقات الفرانسيوم
خلصت الاختبارات التي أجريت على الفئران إلى أن الفرانسيوم يتراكم في الكلى والكبد والغدد اللعابية. إضافة إلى محاولة تطبيقه في الطب النووي في تشخيص السرطان ، لكن صعوبة تحضيره وعزله جعلت المشروع غير مجدٍ. هذه الخاصية ، تضاف إلى عمر النصف المنخفض لها ، تجعل الفرانسيوم واحد من القلائل عناصر لا توجد تطبيقات عملية.
ومع ذلك ، فإن حقيقة وجود ملف أكبر نصف قطر ذري في الجدول الدوري وامتلاك إلكترون واحد فقط في طبقة التكافؤ يثير فضول بعض الباحثين حول طبيعته. في عام 2002 ، تمكنت مجموعة من الباحثين في الولايات المتحدة من حجز 300 ألف ذرة فرانسيوم لمعرفة المزيد عن العنصر.
تحقق من البودكاست الخاص بنا: قاسية مثل الماس: ماذا يعني ذلك؟
تاريخ الفرانسيوم
ما يبرز في تاريخ الفرانسيوم هو عدد المرات التي قال الناس أنهم اكتشفوها بعد ذلك توقع مندليف وجود هذا العنصر في عام 1871، تحت اسم إيكا السيزيوم.
من المعروف منذ فترة طويلة أنه بعد العنصر 83 ، البزموت ، يظهر الجدول الدوري فقط العناصر المشعة وغير المستقرة - مع استثناءات مثل اليورانيوم والثوريوم. ومع ذلك ، فإن هذا لم يثن الكثير من العلماء عن البحث عن العنصر 87 في المصادر الطبيعية ، وفي كثير من الأحيان ، ادعاء اكتشافه.

فمثلا، في عام 1925 ، لاحظ الكيميائي الروسي Dobroserdov ضعف النشاط الإشعاعي في عينة من البوتاسيوم، وخلص إلى أن هذا سيكون العنصر 87 وتسميته الروسيومتكريما لبلده الأم. ومع ذلك ، فإن أفضل تفسير لهذه الحقيقة هو أنه ، في الواقع ، تم الكشف عن النشاط الإشعاعي من النظير. 40K ، باعث بيتا يشكل حوالي 0.012٪ من البوتاسيوم الطبيعي.
في عام 1926 ، قام الكيميائيون الإنجليز دروس ولورينج ، عند تحليل الخطوط الطيفية لكبريتات المنغنيز (II) ، افترضوا أيضًا أنهم لاحظوا بعض الأسطر المتعلقة بالعنصر 87 ، والتي اقترحوا لها لاحقًا اسم القلوية. ومع ذلك ، فإن ضعف الأدلة ثبط عزيمة الباحثين عن المضي قدمًا.
ثم ، في عام 1930 ، ادعى فريد أليسون اكتشاف العنصر 87 بعد بعض التجارب على عينات من polucite (خام غني بالسيزيوم) و lepidolite (خام مع الليثيوم في تكوينه). اقترح أليسون الاسم فيرجينيوم تكريما لولاية فرجينيا الأمريكية. ومع ذلك ، في عام 1934 ، أظهر ماكفيرسون عدم دقة في اكتشاف أليسون.
بعد ذلك بعامين ، جان بيرين ، الفيزيائي الفرنسي المعروف بتأكيده لنظرية أينشتاين للحركة البراونية ، مقدمًا ، وهكذا ، فإن الدليل الكافي على وجود الذرات ، انضم إلى الفيزيائية الرومانية هوريا هولوبي في سلسلة من التجارب على الأشعة. X. ثم حصلوا على النتائج المتوقعة للعنصر 87 ، والتي قاموا بتسميتها على الفور مولدافيوم، في إشارة إلى منطقة مولدوفا ، مسقط رأس هولوبي. ومع ذلك ، مرة أخرى ، تم انتقاد العمل في ضوء التفسيرات.
لم يستطع أي من الباحثين فهم ذلك ، لكن ما حدث هو أن الفرانسيوم له نظائر غير مستقرة للغاية ، مع نصف عمر قصير جدًا. كان سوء الحظ من هذا القبيل تم النظر في عدم وجود العنصر 87.
ومع ذلك ، في عام 1939 ، حدث اكتشاف العنصر 87 من قبل شخص بدأ كمساعد مختبر لأي شخص آخر ماري كوري، في باريس: ال مارغريت الفرنسية بيري. مع خبرة جيدة في التعامل مع العينات المشعة وتنقيتها ، تم تكليف بيري بتحليل عينة مشعة من الأكتينيوم ، العنصر 89.
العالم كان أول من لاحظ انبعاثات ألفا وبيتا الناتجة عن الأكتينيوم، يكشف عن عنصر جديد بعمر نصف يبلغ 21 دقيقة. ثم أعلنت المرأة الفرنسية عن اكتشافها بحذر ، وفي عام 1946 ، دافعت عن أطروحة الدكتوراه الخاصة بها العنصر 87: الأكتينيوم- K.
تم تسمية العنصر الجديد بعد ذلك باسم francium ، تكريماً لبلده الأصلي ، مبدئيًا برمز Fa. في عام 1949 ، أ أكد الاتحاد الدولي للكيمياء البحتة والتطبيقية (Iupac) العنصر بالاسم الذي قدمه بيري، ولكن في عام 1951 تم تغيير الرمز إلى Fr.
تمارين حلها على الفرانسيوم
السؤال رقم 1
الفرانتيوم (Fr ، Z = 87) معدن قلوي بعمر نصف قصير وغير مستقر. ومع ذلك ، فمن المعروف أن لها بعض الخصائص المشابهة للمعادن القلوية الأخرى.
بناءً على المعلومات الواردة أعلاه ، ما هو المركب المحتمل تكوينه بين الفرانسيوم والبروم (Br، Z = 35)؟
أ) الأب2
ب) الاب2ر
ج) FrBr
د) الأب3
رد
الفرانتيوم ، كمعدن قلوي ، يحتوي على أكاسيد النيتروجين يساوي +1. بالفعل البروم ، أ الهالوجين، في حالة عدم وجود الأكسجين فإن أكاسيد النيتروجين يساوي -1. لذلك ، فإن المركب الأكثر احتمالا بينهم هو الحرف C ، FrBr.
السؤال 2
يعتبر نصف القطر الذري خاصية دورية بالغة الأهمية ، حيث إنه لا يميز الذرات من حيث أحجامها فحسب ، بل يساعد أيضًا في فهم التفاعل والخصائص الأخرى للذرات.
من بين عناصر الجدول الدوري ، العنصر الذي له أكبر نصف قطر ذري هو:
أ) و
ب) ج
ج) ح
د) الاب
ه) عوج
رد
من المعروف أن نصف القطر الذري أكبر كلما زادت فترة العنصر وصغر عدد الإلكترونات في طبقة التكافؤ. وبالتالي ، فإن العنصر الذي له أكبر نصف قطر هو francium ، Fr ، كما هو الحال في الفترة السابعة من الجدول الدوري وله إلكترون تكافؤ واحد فقط.
بقلم ستيفانو أروجو نوفايس
مدرس كيمياء
