ال ايزومرية إنها ظاهرة تُلاحظ عندما تتكون مركبات مختلفة بكميات متساوية من نفس أنواع الذرات.
لذلك ، يمكننا العثور على مواد كيميائية لها نفس الصيغة الجزيئية والصيغ التركيبية المختلفة أو الترتيبات المكانية.
لوحظت هذه الظاهرة على نطاق واسع في الكيمياء العضوية ، التي تدرس مركبات الكربون. نظرًا لأن كل ذرة من هذا العنصر يمكنها تكوين 4 روابط كيميائية ، فمن الممكن ملاحظة مجموعات مختلفة.
نظرًا لأن التغيير في ترتيب الذرات يؤدي إلى ظهور مواد جديدة ، فإن لها خواص فيزيائية وكيميائية مختلفة.
عندما نقول ما هي المركبات نظائر تعني أن لهما أجزاء متساوية ، حيث أن الكلمة عبارة عن مزيج من مصطلحين من أصل يوناني: ايزوس، تعني "حقًا" ، و مجرد، وهي "الأجزاء".
المجموعتان الرئيسيتان من الأيزومرية هما المستوي والفضاء (الأيزومرية الفراغية).
ال التماثل المسطح يمكن تصورها من خلال الصيغة الهيكلية المسطحة للمركبات ولها خمس فئات: الموضع ، والوظيفة ، والسلسلة ، والتعويض ، والحشو.
ال تماثل الفضاء يتم ملاحظته من خلال اتجاه المركبات وينقسم إلى هندسي (cis-trans) وبصري.
تم تقديم مفهوم التماثل في عام 1830 من قبل العالم السويدي جاكوب برزيليوس.
أمثلة على الايزومرات
ال سلسلة تماثل يحدث عندما تتصل نفس مجموعة الذرات لتكوين هياكل من نفس المجموعة الوظيفية ، ولكن بسلاسل مختلفة.
مثال: الصيغة الجزيئية ج4ح10 يمكن أن يكون الهيدروكربون مستقيماً أو متفرعاً.

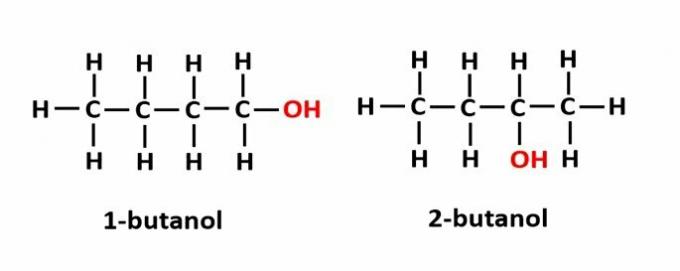
ال موقف isomerism يحدث عندما تتكون المركبات من نفس المجموعات الوظيفية ، لكنها في مواقع مختلفة في السلسلة.
مثال: الصيغة الجزيئية ج4ح9يتوافق OH مع نوعين من الكحول.
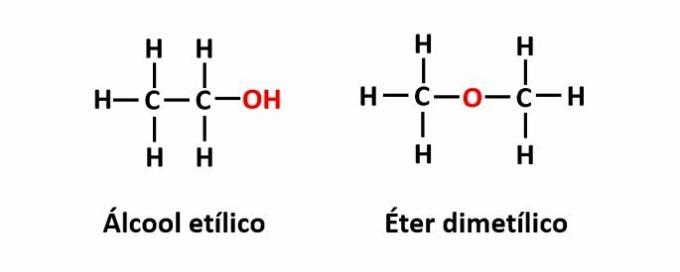
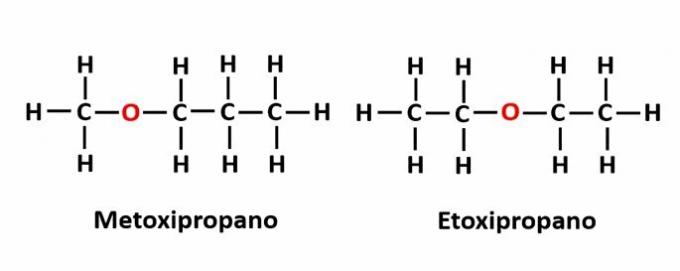
ال وظيفة التماثل يحدث عندما تتوافق نفس الصيغة الجزيئية مع مركبين لهما مجموعات وظيفية مختلفة.
مثال: الصيغة الجزيئية ج2ح6يتوافق O مع اثنين من أيزومرين لهما وظائف الكحول (-OH) والأثير (-O-).
ال ايزومرية التعويض يحدث عندما يكون هناك ذرة غير متجانسة في السلسلة وتحتل مواقع مختلفة. هذه حالة خاصة من تماثل الموضع.
مثال: الصيغة الجزيئية ج4ح10يشير الرمز إلى وجود ذرة أكسجين في السلسلة ، لكن موضعها يمكن أن يتغير ويشكل مركبات مختلفة.
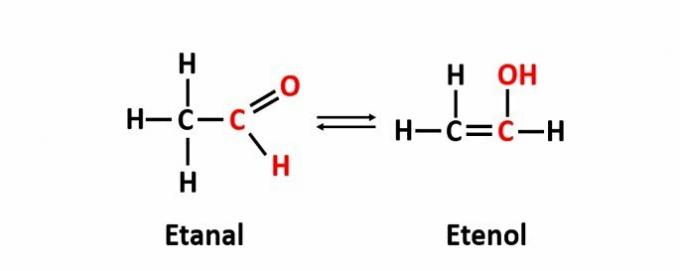
ال التماثل الديناميكي، وتسمى أيضًا الحشو ، تحدث عندما يكون هناك مركبان لهما وظائف مختلفة في نفس الحل في التوازن الديناميكي. هذه حالة خاصة من التماثل الوظيفي.
مثال: الصيغة الجزيئية ج2ح4يتوافق O مع المركبات ذات وظائف الألدهيد وإينول.
تعلم المزيد عن التماثل المسطح.
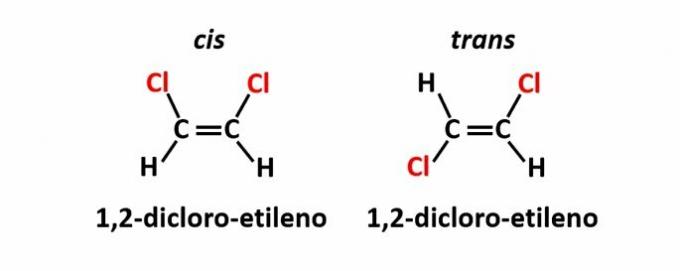
ال تماثل هندسي، وتسمى أيضًا isomery رابطة الدول المستقلة عبر، يحدث عندما يؤدي وجود رابطة مزدوجة أو بنية دورية إلى وجود روابط متساوية على نفس الجانب من المستوى (رابطة الدول المستقلة) أو على طرفي نقيض (عبر).
مثال: ذرات الكلور في مركبات الصيغة الجزيئية ج2ح2Cl2 قد يكون لديهم هيكلان مكانيان.
ال التماثل البصري يحدث عندما تنحرف المركبات عن الضوء المستقطب المنبعث على الهيكل ، حيث تنجح في تشتيت الحزمة مضيئة إلى اليسار ، إذا كانت متزامنة (l) ، أو إلى اليمين ، عندما تكون متزامنة (د).
مثال: يحدث هذا النوع من الأيزومرية مع حمض اللاكتيك. لاحظ أدناه أن الصور الطيفية للأيزومرات لا تتداخل ، ومن ثم يطلق عليها enantiomers.
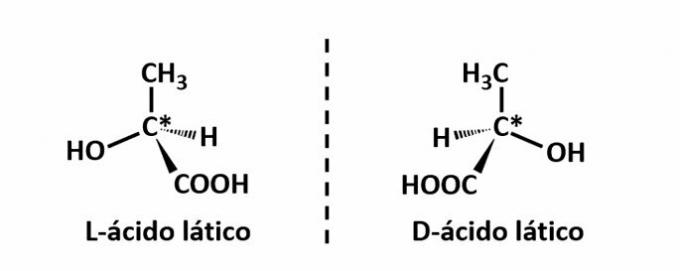
يشير الرمز C * إلى وجود الكربون اللولبي في هذه البنية ، أي ذرة كربون ذات 4 روابط مختلفة.
تعرف على المزيد حول التماثل مع المحتويات:
- أنواع التماثل
- ايزومير الفضاء
- ايزومر هندسي
- الايزومر البصري
- تمارين على التماثل المستوي