ال الطاقة الداخلية الكامنة هي وظيفة ديناميكية حرارية يتم بواسطتها يحسب الحرارة المتضمنة في عمليات متساوية الضغط، أي التي يتم وضعها تحت ضغط مستمر. حدث تطورها بعد فترة وجيزة من سقوط نظرية السعرات الحرارية ، مع تقدم الديناميكا الحرارية بين عامي 1840 و 1850.
المحتوى الحراري ، لـ ماذا او ماأوميكا، ليس له معنى كبير إذا تم استخدامه كقيمة مطلقة ومعزولة ، ولكنه يكون كذلك عند النظر في تباين قيمته في عملية كيميائية. هناك عدة طرق لحساب تباين المحتوى الحراري لعملية ما ، أهمها من خلال طاقات التكوين والربط وأيضًا بواسطة هناكمرحبا من هيس.
اقرأ أيضا: ما هي الطاقة الحرة جيبس؟
ملخص المحتوى الحراري
المحتوى الحراري هو أداة ديناميكية حرارية لحساب الحرارة المتضمنة في العمليات التي تحدث عند ضغط ثابت.
تم تعريفه من قبل الفيزيائي الأمريكي يوشيا و. جيبس ، في سياق سقوط نظرية السعرات الحرارية.
في الكيمياء ، نستخدم دائمًا تغيير المحتوى الحراري ، الذي يتم تمثيله بـ ΔH.
التفاعلات الكيميائية التي تمتص الحرارة تسمى ماص للحرارة ولها ΔH> 0.
التفاعلات الكيميائية التي تطلق الحرارة تسمى طاردة للحرارة ولها ΔH <0.
درس فيديو عن المحتوى الحراري
ما هو المحتوى الحراري؟
المحتوى الحراري ، الذي يتم تمثيله دائمًا بـ H ، كان مبدئيًا الذي حدده الفيزيائي الأمريكي يوشيا ويلارد جيبسوالتي سماها وظيفة الحرارة عند الضغط المستمر ، حيث قال على لسانه:
"[...] يمثل النقص في الوظيفة ، في جميع الحالات التي لا يتغير فيها الضغط ، الحرارة التي يتخلى عنها النظام."
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
من عمل جيبس ، إذن ، يمكننا أن نفهم المحتوى الحراري على أنه وظيفة ديناميكية حرارية الاختلاف يساوي عدديًا مقدار الحرارة المتبادلة في النظام ، إلى الضغط ثابت. هذا يعني أنه في العمليات متساوية الضغط (مثل معظم العمليات الكيميائية) ، يجب أن تعرف بحساب تباين دالة المحتوى الحراري ، يمكن للمرء بعد ذلك معرفة قيمة الحرارة المتبادلة بين النظام و حي.

مثل هذا الارتباط مع أسباب الحرارة يعتقد العديد من الطلاب خطأً أن المحتوى الحراري مرادف لـ الحرارة أو شيء مثل محتوى الطاقة والمحتوى الحراري والحرارة المنبعثة والحرارة الممتصة وما شابه.
نشأ المحتوى الحراري في سياق انهيار نظرية السعرات الحرارية ، التي تعاملت مع الحرارة على أنها مادة مادية لا يمكن السيطرة عليها ، تم نقلها من أجسام أكثر دفئًا إلى أجسام أكثر برودة. وبالتالي ، كانت هناك حاجة لوجود أداة جديدة لحساب الحرارة. كان الحل إذن هو استخدام الكميات التي سبق أن حددت المعادلات الديناميكية الحرارية ، مثل المحتوى الحراري.
اقرأ أيضا: كيف تحسب التغير في المحتوى الحراري للحل؟
اختلاف المحتوى الحراري
نظرًا لأن المحتوى الحراري هو أداة تُستخدم لحساب الحرارة المتبادلة في عملية كيميائية ، فليس من المنطقي استخدامها كرقم مطلق ومعزول ، ولكن بالنظر إلى تباينها ، أي في الممارسة العملية ، يجب علينا فقط تقييم مقدار التغير العددي في المحتوى الحراري أثناء العملية الكيميائية ، لأن الديناميكا الحرارية تؤكد لنا أن الاختلاف يساوي عدديًا الحرارة المنبعثة أو الممتصة في العملية.
بالمعنى الدقيق للكلمة ، يمكننا تحديد اختلاف المحتوى الحراري على النحو التالي:
ΔH = H.أخير - حمبدئي
كما هو الحال في العمليات الكيميائية ، يمكن اعتبار الخطوة النهائية المنتجات والخطوة الأولية يمكن اعتبارها الكواشف. من الشائع أيضًا رؤية تعريف تباين المحتوى الحراري على النحو التالي:
ΔH = H.منتجات - حالكواشف
من وجهة نظر عملية وتفسيرية ، إذا كان التغير في المحتوى الحراري موجبًا (ΔH> 0)، نقول أن التفاعل الكيميائي ماص للحرارة، أي أن هناك امتصاص للحرارة طوال العملية. بالفعل إذا كان التغير في المحتوى الحراري سالبًا (ΔH < 0)، نقول أن التفاعل الكيميائي طارد للحرارة، أي ، يتم إطلاق الحرارة طوال العملية.
يتم ملاحظة اختلاف المحتوى الحراري ، في كثير من الحالات ، في الرسوم البيانية ، كما هو موضح في الأمثلة التالية.
مثال 1:
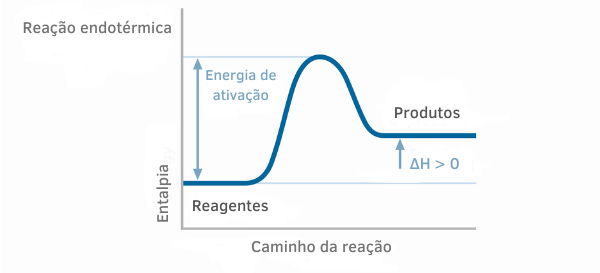
مخطط التفاعل الماص للحرارة
في الرسوم البيانية للمحتوى الحراري للتفاعلات الماصة للحرارة ، يمكن ملاحظة أن كمية المحتوى الحراري للمنتجات أكبر من تلك الخاصة بالمواد المتفاعلة ، مما يشير إلى أن التباين على طول التفاعل إيجابي. وبالتالي ، إذا كانت H> 0 ، فيمكننا القول أن العملية الكيميائية حدثت مع امتصاص الحرارة.
المثال 2:
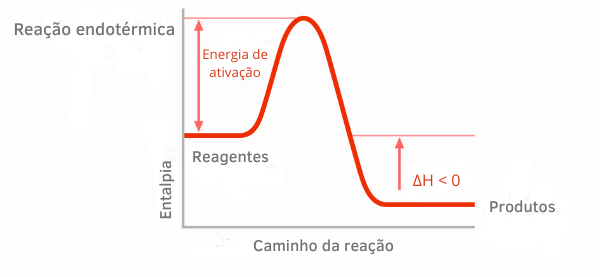
مخطط التفاعل الطارد للحرارة:
في الرسوم البيانية للمحتوى الحراري للتفاعلات الطاردة للحرارة ، يمكن ملاحظة أن كمية المحتوى الحراري للمنتجات أصغر من تلك الخاصة بالمواد المتفاعلة ، مما يشير إلى أن التباين على طول التفاعل سلبي. وبالتالي ، بكوننا ΔH <0 ، يمكننا القول أن العملية الكيميائية حدثت مع إطلاق الحرارة.
اقرأ المزيد عن هذه التصنيفات للتفاعلات الكيميائية في النص: لعمليات ماصة للحرارة وطاردة للحرارة.
أنواع المحتوى الحراري
المحتوى الحراري للتكوين
ال المحتوى الحراري للتكوين é محسوب على أساس تفاعلات كيميائية للتشكيل، وهي التفاعلات التي يتكون فيها مول واحد من المواد المركبة من أكثر المواد البسيطة ثباتًا في درجة حرارة الغرفة وجو واحد من الضغط.
ح2(ز) + ½ يا2 (ز) → H.2O (ل) H °F = -286 كيلوجول / مول
الميزة الكبرى للمحتوى الحراري للتكوين هي أن المواد البسيطة الأكثر ثباتًا في درجة حرارة الغرفة وجو واحد من الضغط لها محتوى حراري متفق عليه على الصفر. هذا لا يعني أنهم في الواقع صفر ، ولكن من أجل التبسيط والتصنيف الأفضل ، يتم التعامل معهم على هذا النحو.
يجرى ح = حمنتجات - حالكواشف، إذا أخذنا في الاعتبار ، إذن ، أن H.الكواشف = 0، يمكننا القول أن القيمة الملحوظة لـ ΔH تتعلق فقط بالمنتجات ، والتي ، في هذه الحالات ، دائمًا ما تكون مولًا واحدًا من المادة المركبة. لذلك ، نقوم بجدولة هذه القيمة على أنها تباين المحتوى الحراري القياسي لتكوين الماء ، والذي يمثله ΔH °F.
كان مع هذه المنهجية أن العديد من المواد كان لها اختلافات في المحتوى الحراري القياسي جداول التشكيل كما نرى أدناه.
مستوى |
المحتوى الحراري للتكوين (ΔH °F) في كيلوجول / مول |
كو2 (ز) |
-393,4 |
CaO (ق) |
-634,9 |
مرحبا (ز) |
+25,9 |
لا (ز) |
+90,1 |
المحتوى الحراري الملزم
يعمل المحتوى الحراري الملزم على تحديد كمية الطاقة المتضمنة في تمزق أو تكوين مول معين. رابطة كيميائية.
من المفهوم أن، لكسر رابطة كيميائية ، من الضروري امتصاص الحرارة، بحيث تزيد ذرات الترابط الطاقة الداخلية وبالتالي زيادة الطاقة الحركية الخاصة بك. مع أكبر الطاقة الحركية، فإن الذرات تهتز بشكل أكثر كثافة ، مما يؤدي إلى تكسير الروابط. وبالتالي ، فإن كل كسر للرابطة هو عملية ماصة للحرارة.
خلاف ذلك ، لتشكيل رابطة كيميائية ، تفقد الذرات حرية الحركة وتحتاج إلى تقليل درجة حركتها ، مما يقلل من طاقتها الحركية. ثم يتم إطلاق الطاقة الاحتياطية في شكل حرارة. هكذا، كل تكوين الرابطة هو عملية طاردة للحرارة.
يوضح الجدول أدناه قيم الطاقات المرتبطة بكل رابطة كيميائية.
اتصال |
طاقة الربط (كيلوجول / مول) |
سي اتش |
412,9 |
نسخة |
347,8 |
O═O |
497,8 |
F-F |
154,6 |
لا |
943,8 |
لاحظ أنه لا توجد علامات في القيم ، لأنها في المعامل. هذا لأنه يجب تعيين الإشارة بواسطتك اعتمادًا على ما إذا كان الارتباط معطلاً أو تم تشكيله.
المحتوى الحراري الاحتراق
ال المحتوى الحراري الاحتراق يعمل على الإشارة إلى كمية الحرارة المنبعثة من احتراق مول واحد من مادة ما. وتجدر الإشارة إلى أن كل تفاعل احتراق يكون طاردًا للحرارة ، حيث إن كل احتراق يطلق حرارة.
CH4 (ز) + 2 س2 (ز) → CO2 (ز) + 2 ح2ΔH °ج = -889.5 كيلوجول / مول
يوضح الجدول أدناه المحتوى الحراري لقيم الاحتراق لبعض المواد الكيميائية.
مستوى |
المحتوى الحراري الاحتراق (ΔH °ج) في كيلوجول / مول |
الإيثانول - سي2ح5أوه (1) |
-1368 |
البنزين - سي6ح6 (1) |
-3268 |
اوكتان - سي8ح18 (1) |
-5471 |
الجلوكوز - سي6ح12ا6 (س) |
-2808 |
المحتوى الحراري لتغيير الحالة المادية
كل تغيير في الحالة الفيزيائية ينطوي على تبادل حراري. لذلك ، فإن المحتوى الحراري لتغيير الحالة المادية يعمل على الإشارة إلى كمية الحرارة المتضمنة في عمليات تغيير الحالة الفيزيائية.
على سبيل المثال ، لدينا تبخير الماء:
ح2O (1) → H.2O (ز) ΔH = +44 كيلوجول / مول
في ذوبان الماء لدينا:
ح2O (ق) → H.2O (l) ΔH = +7.3 كيلوجول / مول
قيم المحتوى الحراري متماثلة للعمليات العكسية، وهو ما يعني ، على سبيل المثال ، أن التغير في المحتوى الحراري في إسالة الماء هو -44 كيلو جول / مول ، بينما في حالة تصلبها ، فإنها تساوي -7.3 كيلو جول / مول.
اقرأ أيضا: ما هو الانتروبيا؟
تمارين حلها على المحتوى الحراري
السؤال رقم 1 - (UERJ 2018) يتم تحديد سعة تلوث الهيدروكربون المستخدم كوقود من خلال النسبة بين الطاقة المنبعثة وكمية ثاني أكسيد الكربون2 تشكلت في احتراقها الكامل. كلما ارتفعت النسبة ، انخفضت قدرة التلوث. يوضح الجدول أدناه المحتوى الحراري القياسي لاحتراق أربعة هيدروكربونات.

من الجدول ، الهيدروكربون الأقل قدرة على التلوث هو:
أوكتان
الهكسان
البنزين
البنتان
الدقة
البديل د
يشير السؤال إلى أن السعة الملوثة يتم تعريفها على أنها النسبة (الحاصل) بين الطاقة المنبعثة وكمية ثاني أكسيد الكربون2 تشكلت في احتراقها الكامل. كلما كان ملف السببفكلما انخفضت قدرة التلوث ، يتم إطلاق المزيد من الطاقة لكل مول من ثاني أكسيد الكربون2 ولدت.
تفاعلات الاحتراق الكامل لـ الهيدروكربونات المذكورة هي:
أوكتان: ج8ح18 +25/2 س2 → 8 كو2 + 9 ساعات2السبب: 5440/8 = 680
الهكسان: ج6ح14 +19/2 س2 → 6 كو2 + 7 ساعات2السبب: 4140/6 = 690
البنزين: ج6ح6 + 15/2 س2 → 6 كو2 + 3 ح2السبب: 3270/6 = 545
البنتان: ج5ح12 + 8 س2 → 5 كو2 + 6 ح2السبب: 3510/5 = 702
وبالتالي ، يمكننا أن نستنتج أن البنتان هو الهيدروكربون الأقل قدرة على التلوث.
السؤال الثاني - (Enem 2015) أصبح استخدام مخلفات الغابات أكثر جاذبية كل يوم ، لأنها مصدر متجدد للطاقة. يمثل الشكل حرق الزيت الحيوي المستخرج من نفايات الخشب ، حيث ΔH1 تباين المحتوى الحراري الناتج عن احتراق 1 جرام من هذا الزيت الحيوي ، مما ينتج عنه ثاني أكسيد الكربون والماء السائل ، و ΔH2 تغيير المحتوى الحراري المتضمن في تحويل 1 جرام من الماء في حالة غازية إلى حالة سائلة.

تباين المحتوى الحراري ، بالكيلوجول ، لحرق 5 جرام من هذا الزيت الحيوي ، مما ينتج عنه ثاني أكسيد الكربون2 (غازي) و H2أما (الغازية) فهي:
أ) -106
ب) -94
ج) -82
د) -21.2
هـ) -16.4
الدقة
البديل ج
من الرسم البياني الموضح لدينا ΔH1 كتنوع المحتوى الحراري لثاني أكسيد الكربون الناتج عن حرق الزيت الحيوي2 (ز) و H.2O (1) و ΔH2 كتغيير المحتوى الحراري لإسالة الماء ، منذ ثاني أكسيد الكربون2 يبقى غازيًا والحالة الفيزيائية فقط لـ ماء التغييرات (من الغاز إلى السائل).
يتطلب التمرين تغيير المحتوى الحراري لحرق 5 جم من الزيت الحيوي ، مما ينتج عنه ثاني أكسيد الكربون2 (غازي) و H2O (غازي). من المخطط ، يمكن تعريف هذا التغيير في المحتوى الحراري على أنه ΔH = ΔH1 - ح2. وبالتالي ، فإن قيمة ΔH ستكون مساوية لـ -16.4 kJ / g. هذا الاختلاف ، كما نرى في الوحدة ، هو لكل جرام من الزيت الحيوي. مقابل 5 جرام ، يجب أن نفعل نسبة:
1 جرام من الزيت الحيوي -16.4 كيلو جول
5 غرام من الزيت الحيوي x
1. س = 5. (-16,4)
س = -82 كيلو جول
يمكننا بعد ذلك تحديد البديل C.
بقلم ستيفانو أروجو نوفايس
مدرس كيمياء