في تفاعلات الاحتراق هم موجودون في العديد من جوانب حياتنا اليومية. على سبيل المثال ، تنجم المصادر الرئيسية لتوليد الطاقة عن احتراق أو حرق بعض أنواع الوقود ، مثل الإيثانول والبنزين والفحم وغيرها. علاوة على ذلك ، فإن الطاقة التي نحتاجها للبقاء على قيد الحياة والقيام بالعمل هي نتيجة تفاعلات الاحتراق التي تحدث داخل خلايانا عندما "نحرق" الطعام الذي نأكله.
ولكن ما الذي يتطلبه حدوث تفاعل الاحتراق؟
هناك حاجة لثلاثة أشياء:
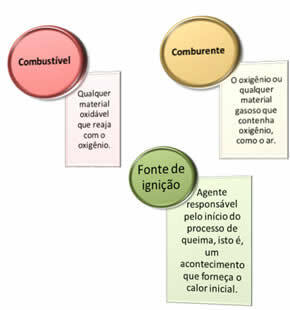
هذه العوامل الثلاثة تشكل مثلث النار، لأنه بمجرد بدء تفاعل الاحتراق ، تحافظ الطاقة المنبعثة على التفاعل وتسمح له بالاستمرار حتى يختفي الوقود أو المؤكسد أو الحرارة (الطاقة المحررة). هذا يعني أنه سيكون هناك ملف تفاعل تسلسلي.
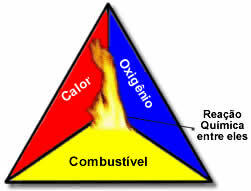
على سبيل المثال ، إذا ألقى شخص ما سيجارة مشتعلة في غابة ، فسيكون هناك حريق (تفاعل احتراق). في هذه الحالة ، فإن دفع انها ال الوقوديا الأكسجين الموجود في الهواء الغلاف الجوي هو مؤكسد انها ال سيجارة مضاءة كان مصدر الإشعال. سيستمر هذا الحرق حتى يتم التخلص من أحد العوامل الثلاثة. إذا قام رجال الإطفاء بإلقاء الماء ، سيتم القضاء على الحرارة. ولكن حتى إذا لم يتم فعل أي شيء لوقف هذا الاحتراق ، فسوف ينتهي في مرحلة ما ، أي عندما ينفد الوقود (الغابة).
كما ذكرنا سابقًا ، يتم إطلاق الحرارة في هذه التفاعلات ، وبالتالي فإن الاحتراق هو تفاعل طارد للحرارة. ومع ذلك ، فإن هذا النوع من التفاعل هو احتراق غير كامل. لفهم السبب ، انظر إلى الفرق بين الاحتراق الكامل والاحتراق غير الكامل:
الاحتراق الكامل:
عند تحليل المركبات العضوية كوقود ، يتعين علينا:
| ال احتراق كامل سيحدث عندما تنكسر سلسلة الكربون وتتأكسد جميع ذرات الكربون في سلسلة الكربون تمامًا. |
| أنت المنتجات المشكلة بواسطة الهيدروكربونات سيكون كو2 (ثاني أكسيد الكربون) و ح2ا (ماء). |
راقب الاحتراق الكامل للإيزوكتان ، وهو أحد مكونات البنزين.
ج8ح18 (ز) +25/2 س2 (ز) → 8 كو2 (ز) + 9 ساعات2ا(1)
احتراق غير كامل
| في هذه الحالة ، لا يوجد مؤكسد كافٍ ، أي ما يكفي من الأكسجين لحرق كل الوقود. |
| وبالتالي ، فإن المنتجات المتكونة هي كو (أول أكسيد الكربون) و ح2ا. |
لاحظ نفس احتراق الأيزوكتان ، ولكن الآن بشكل غير كامل:
ج8ح18 (ز) + 17/2 س2(ز) → 8 كو (ز) + 9 ساعات2ا(1)
يعد حرق الغابات مثالاً على ذلك ، حيث تتكون الانبعاثات الناتجة من ثاني أكسيد الكربون ومواد معينة ، مثل السخام (C) ، بالإضافة إلى الرماد والمركبات العضوية البسيطة والمعقدة الأخرى. يمكن أيضًا تكوين أكسيد النيتروجين والأوزون والألدهيدات نتيجة تفاعلات ثانوية بسبب وجود مكونات أخرى في الهواء.
ج8ح18 (ز) + 9/2 س2 (ز) → 8 ج (ز) + 9 ساعات2ا(1)
بقلم جينيفر فوغاسا
تخرج في الكيمياء
فريق مدرسة البرازيل
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm
