ينتج عن هذا الخليط من الغازات مخاليط متجانسة أو محاليل غازية. على سبيل المثال ، الغازات التي تخرج من مداخن المصانع ، أو عوادم السيارات ، تنتشر في الهواء الغلاف الجوي ، ومع مرور الوقت ، لم نعد قادرين على التمييز بينها ، حيث كان هناك انتشار لهذه الغازات عبر هواء.

تنتشر الغازات المنبعثة من المداخن و "تضيع" في هواء الغلاف الجوي ، لأن حجم الهواء أكبر بكثير من حجم الدخان.
| ال تعريف الغاز عبارة عن حركة عفوية للغاز عبر آخر ، أي ينتشر في وسط غازي آخر. |
| ال التدفق الغازات هي نوع خاص من الانتشار ، حيث يحدث تسرب للغازات من خلال ثقوب صغيرة (أو جدران مسامية ، وهي عبارة عن مجموعة من الثقوب الصغيرة). |
على سبيل المثال ، يتم تعبئة البالونات المباعة للأطفال بغاز الهيليوم. بمرور الوقت ، ينتهي هذا الغاز بالمرور عبر مسام البالون المطاطية ، أي أن هناك انصبابه. يتضح هذا من حقيقة أن البالون يفرغ من الهواء بعد بضع ساعات.
درس الكيميائي الاسكتلندي توماس جراهام ، في عام 1829 ، سلوك الغازات هذا. وخلص إلى أن السرعة التي ينتشر بها الغاز أو يتدفق في غاز آخر مرتبطة بكثافته. نظرًا لتكرار بياناته التجريبية لجميع الغازات ، فقد أنشأ القانون التالي الذي يحمل اسمه:
قانون جراهام: معدل انتشار أو انصباب الغاز يتناسب عكسياً مع الجذر التربيعي لكثافته.
رياضيا ، يمكن التعبير عن هذا القانون بالمعادلة:
ت α 
أو فيما يتعلق بغازين مختلفين ، لدينا:
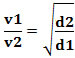
الوحدة المستخدمة في هذه الحالة هي "الحجم الذي يتسرب لكل وحدة زمنية" ؛ لذلك بشكل عام لتر / دقيقة (لترات في الدقيقة).
وبالتالي ، فإن الغازات ذات الكثافة المنخفضة تنتشر بشكل أسرع. إذا كانت في نفس درجة الحرارة وحالة الضغط ، يمكنك أيضًا ربط ذلك بالكتلة الغاز المولي: كلما زادت كثافة الغاز ، زادت كتلته المولية وانخفضت سرعته تعريف؛ والعكس صحيح. وهكذا لدينا:
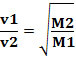
بقلم جينيفر فوغاسا
تخرج في الكيمياء
فريق مدرسة البرازيل
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/difusao-efusao-dos-gases.htm
