يسمى نموذج رذرفورد الاقتراح الذي قدمه العالم إرنست رذرفورد للذرة في عام 1911 ، بهدف إظهار الشكل المثالي وتكوين مكونات المادة: ذرة.
ا نموذج رذرفورد يُعرف عمومًا باسم نموذج النظام الشمسي ، حيث تمت مقارنة هيكله وعمله بالعلاقة بين الشمس والكواكب التي تدور حولها.
في نموذجه ، قارن رذرفورد الشمس بنواة الذرة ، وتمت مقارنة إلكترونات الذرة بكواكب النظام الشمسي ، كما يتضح من التمثيل التالي:
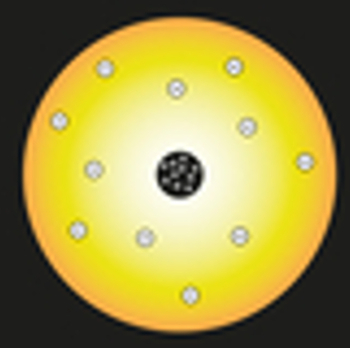
تمثيل لنموذج رذرفورد الذري
داخل النواة ، سيتم وضع الجسيمات المشحونة إيجابياً ، والتي تسمى البروتونات (اكتشفها يوجين جولدشتاين). ستكون هذه النواة صغيرة وكثيفة وستحتوي على أكبر كتلة من الذرة.
التجربة التي أجراها رذرفورد
كانت جميع مقترحات رذرفورد لإنشاء نموذجه الذري نتيجة لتجربة ركز فيها على حزم من إشعاع ألفا (نشأت من من البولونيوم المشع الموجود في صندوق رصاص) على صفيحة ذهبية رفيعة ، مع صفيحة معدنية مغطاة بكبريتيد الزنك من الخلف وعلى الجانبين. الجوانب. كبريتيد الزنك هو ملح يلمع عند تلقيه للإشعاع.
ثم لاحظ رذرفورد أن ثلاث نقاط (أ ، ب ، ج) على وجه الخصوص توهجت خلال هذه التجربة:
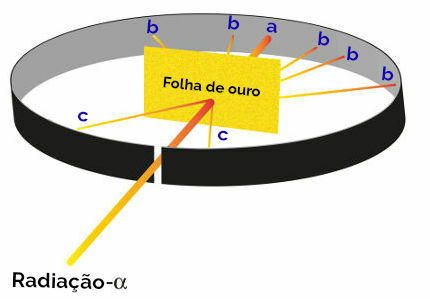
تمثيل تجربة رذرفورد
نقطة أ (نسبة عالية من اللمعان): يشير إلى أن إشعاع ألفا عبر الصفيحة الذهبية دون أي مشكلة ، حيث سيكون في اتجاه فتحة فتحة كتلة الرصاص ؛
النقطة ب (حدوث ضئيل للتوهج): يشير إلى أن إشعاع ألفا عبر الصفيحة الذهبية ، لكنه سينحرف أثناء العبور ؛
النقطة ج (مقدار ضئيل للغاية من التوهج): يقع أمام الشفرة الذهبية ، يشير إلى أن إشعاع ألفا لم يمر.
عزا رذرفورد هذه النتائج الملحوظة إلى الذرات التي تشكل الصفيحة الذهبية ، مفسراً ما يلي:
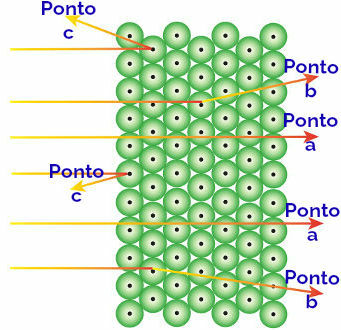
تمثيل سلوك إشعاع ألفا والذرات
يصل إشعاع ألفا إلى يشير إلى: إشعاع ألفا موجب ويمر عبر منطقة من ذرة مساحات فارغة ضخمة. توجد أيضًا إلكترونات في بعض المدارات.
يصل إشعاع ألفا إلى النقطة ب: إشعاع ألفا يمر عبر ذرات الصفيحة الذهبية ، لكنه يصل إلى لحظة معينة عندما يمر بالقرب من النواة الصغيرة للذرة ، والتي تكون موجبة الشحنة ، مما يولد تنافرًا في إشعاع.
يصل إشعاع ألفا إلى النقطة ج: يمر إشعاع ألفا عبر ذرات الصفيحة الذهبية ، لكنه يصطدم بنواة صغيرة مشحونة إيجابًا ، مما يولد تنافرًا في الإشعاع.
إشكاليات نموذج رذرفورد
أشار العديد من علماء الفيزياء إلى بعض المشكلات في النموذج الذي اقترحه رذرفورد:
المشكلة الأولى: كيف يمكن أن تكون النواة موجبة الشحنة ممكنة إذا تنافرت الجسيمات موجبة الشحنة بعضها البعض؟
المشكلة الثانية: لماذا لا تنجذب الإلكترونات الموجودة في الكرات الكهربائية إلى البروتونات في النواة؟
المشكلة الثالثة: لماذا لا تفقد الإلكترونات ، وهي أجسام صغيرة في حركة مستمرة ، طاقتها وتسقط في النواة؟
* اعتمادات الصورة: سفيتش / صراع الأسهم
بي ديوغو لوبيز دياس
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-modelo-rutherford.htm
