ك هو الاختصار المستخدم لتحديد ثابت التوازن من حيث الضغوط الجزئية. يعمل هذا الثابت مع قيم المشاركين الغازيين للتوازن في وحدة الصراف الآلي ، على سبيل المثال.

معادلة تمثل تفاعل كيميائي مع مكونات غازية
في هذه المعادلة ، يكون جميع المشاركين غازيين ، لذلك عندما يكون للغاز المشارك a ضغط جزئي في الخليط، ويمثلها الاختصار pX.
عند إعداد معادلة التوازن الكيميائي (من حيث التركيز) ، يجب وضع المنتجات في البسط وتوضع المواد المتفاعلة في المقام:
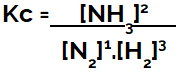
تعبير Kc عن توازن تكوين الأمونيا
التعبير عن ثابت التوازن من حيث الضغط (Kp) يتبع نمط كيه سي، أي أن الضغوط الجزئية للكواشف موضوعة في المقام والضغوط الجزئية للمنتجات في البسط:
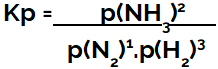
تعبير Kp عن توازن تكوين الأمونيا
الملاحظة: إذا كانت معادلة رد الفعل التوازن الكيميائي لا تقدم أي مشارك غازي ، فلن يظهر تلقائيًا ك.
مثال: (PUC-MG) للتفاعل: 2 CO(ز) + س2 (ز)? 2 كو2 (ز)، والضغوط الجزئية لثاني أكسيد الكربون(ز) انها ال2 (ز) عند التوازن يكونان ، على التوالي ، 0.2 atm و 0.4 atm. يبلغ ضغط النظام الإجمالي 1.4 ضغط جوي. قيمة ال ك لرد الفعل هو:
أ) 56.2
ب) 40.0
ج) 35.6
د) 28.4
هـ) 25.6
البيانات التي يوفرها التمرين هي:
الضغط الجزئي لأول أكسيد الكربون (pCO) = 0.2 ضغط جوي ؛
الضغط الجزئي لأول أكسيد الكربون (ص2) = 0.4 ضغط جوي ؛
الضغط الكلي = 1.4 ضغط جوي ؛
لتحديد Kp لهذا النظام ، يجب علينا تنفيذ الخطوات التالية:
الخطوة الأولى: تحديد الضغط الجزئي لأول أكسيد الكربون (pCO2).
لهذا ، تذكر فقط أن الضغط الكلي (pt) هو مجموع كل الضغوط الجزئية:
pt = pCO + pCO2 + ص2
1.4 = 0.2 + ع (كو2) + 0,4
1.4 - 0.2 - 0.4 = pCO2
pCO2 = 0.8 أجهزة الصراف الآلي
الخطوة الثانية: حدد Kp للتمرين.
لهذا ، ما عليك سوى استخدام القيم في التعبير عن ثابت التوازن Kp:
Kp = (pCO2)2
(pCO)2.(تراب2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 ضغط جوي-1
بي ديوغو لوبيز دياس
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm