ا الحرارة هي الطاقة الحرارية العابرة بين جسمين ، مدفوعة بالاختلاف في درجة الحرارة. تتدفق هذه الطاقة دائمًا من الجسم ذي أعلى درجة حرارة إلى الجسم مع أدنى درجة حرارة ، ولا يتوقف تدفقها إلا عندما تصبح درجة حرارة الأجسام المعنية متساوية.
أنواع الحرارة
عند تعرضها لمصدر حراري ، يمكن لأي مادة تغيير درجة حرارتها أو تغيير درجة حرارتها. الحالة الفيزيائية للتجميع من الجزيئات.
يقال الحرارة حساس عندما يكون قادرًا فقط على تغيير درجة حرارة الجسم. يقال الحرارة كامن عندما يغير درجة الحرارة ويحدث تغيرًا في حالة تجمع جزيئات المادة.
حساب الحرارة الكامنة
كمية الحرارة الكامنة يتم تحديده من خلال ناتج كتلة (م) من الجسم التي خضعت لتحول الحالة وما يسمى بالحرارة الكامنة للانصهار أو التبخر (L).
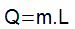
تسمى كمية الحرارة اللازمة لكل جرام من المادة لتغيير حالتها بالحرارة الكامنة للتبخر أو الاندماج. في حالة الماء ، على سبيل المثال ، تكون حرارة التبخر الكامنة 540 كالوري / جم ، أي كل جرام من يحتاج الماء عند 100 درجة مئوية إلى 540 كالوري من الحرارة للخضوع للتغيير من الحالة السائلة إلى الحالة الغازي.
أمثلة
المثال الأول (Uerj) - يوضح الرسم البياني أدناه السلوك الحراري لـ 10 جم من مادة ما ، عند تلقي الحرارة من مصدر ، فإنها تنتقل تمامًا من المرحلة الصلبة إلى الطور السائل.

الحرارة الكامنة لانصهار هذه المادة ، بالكال / جم ، تساوي:
أ) 70
ب) 80
ج) 90
د) 100
الجواب: حرف أ
يمثل الجزء الأفقي من الرسم البياني التغير في الحالة الفيزيائية التي تتوقف فيها الحرارة عن العمل في تغير درجة الحرارة وتبدأ في العمل بطريقة تغير حالة التجميع للعنصر. في هذا الجزء من الرسم البياني ، كانت كمية الحرارة المستخدمة 700 كالوري (1000 - 300 = 700 كالوري).
يمكن تحديد الحرارة الكامنة للانصهار من معادلة الحرارة الكامنة:
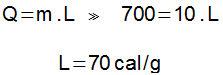
المثال الثاني - كتلة 2000 جم من الماء تساوي بالضبط 100 درجة مئوية. مع العلم أن حرارة تبخر الماء 540 كالوري / جم ، حدد كمية الحرارة بالكيلو كالوري اللازمة لتبخير 30٪ من كتلة الماء.
أ) 224
ب) 250
ج) 300
د) 360
هـ) 324
الجواب: حرف هـ
كتلة الماء التي يجب أخذها في الاعتبار هي 600 غم ، أي ما يعادل 30٪ من إجمالي الماء. وبالتالي ، ستكون كمية الحرارة اللازمة للتبخير:

بقلم جواب سيلاس
تخرج في الفيزياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-calor-latente.htm


