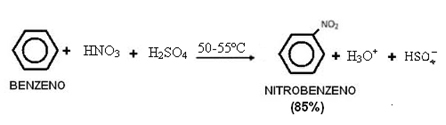
الوظائف غير العضوية هي مجموعات من المركبات غير العضوية لها خصائص متشابهة.
التصنيف الأساسي فيما يتعلق بالمركبات الكيميائية هو: المركبات العضوية هي تلك التي تحتوي على ذرات الكربون ، بينما تحتوي المركبات العضوية على ذرات الكربون. مركبات غير عضوية تتشكل بواسطة العناصر الكيميائية الأخرى.
هناك استثناءات مثل CO ، CO2 و على2كو3، على الرغم من احتوائها على الكربون في الصيغة الهيكلية ، إلا أنها تتميز بخصائص المواد غير العضوية.
الوظائف الأربعة الرئيسية غير العضوية هي: الأحماض والقواعد والأملاح والأكاسيد.
تم تحديد هذه الوظائف الرئيسية الأربع بواسطة أرينيوس ، الكيميائي الذي حدد الأيونات في الأحماض والقواعد والأملاح.
الأحماض
الأحماض إنها مركبات تساهمية ، أي أنها تشترك في الإلكترونات في روابطها. لديهم القدرة على التأين في الماء وتشكيل الشحنات ، وإطلاق H+ باعتبارها الكاتيون الوحيد.
تصنيف الأحماض
يمكن تصنيف الأحماض وفقًا لكمية الهيدروجين التي يتم إطلاقها في محلول مائي وتتأين وتتفاعل مع الماء لتكوين أيون الهيدرونيوم.
| عدد الهيدروجين المؤين |
|---|
|
أحادي الحموضة: لديهم هيدروجين مؤين واحد فقط. أمثلة: HNO3، حمض الهيدروكلوريك و HCN |
|
حمضي: يحتوي على نوعين من الهيدروجين المتأين. أمثلة: H2فقط4، ح2S و H.2MnO4 |
|
ثلاثي الحموضة: لديها ثلاثة هيدروجين مؤين. أمثلة: H3غبار4 و ح3بو3 |
|
تتراكيدز: لديها أربعة هيدروجين مؤين. أمثلة: H4ص7ا7 |
تقاس قوة الحمض بدرجة التأين. كلما زادت قيمة أقوى هو الحمض لأن:
| درجة التأين |
|---|
|
قوي: لديها درجة تأين أكبر من 50٪. |
|
معتدل: لديها درجة تأين بين 5٪ و 50٪. |
|
ضعيف: لديها درجة تأين أقل من 5٪. |
قد تحتوي الأحماض أو لا تحتوي على عنصر الأكسجين في بنيتها ، وبالتالي:
| وجود الأكسجين |
|---|
|
هيدراكيدز: لا تحتوي على ذرات أكسجين. أمثلة: HCl و HBr و HCN. |
|
الأوكسجين: عنصر الأكسجين موجود في التركيب الحمضي. أمثلة: HClO، H2كو3 و HNO3. |
التسمية الحمضية
يمكن وصف الصيغة العامة للحمض على أنها حxال، حيث يمثل A الأنيون الذي يتكون من الحمض ويمكن أن تكون التسمية الناتجة:
| إنهاء الأنيون | إنهاء الحمض |
|---|---|
|
روح مثال: كلوريد (Cl-) |
مائي مثال: حمض الهيدروكلوريك (HCl) |
|
يمثل مثال: كلورات |
ich مثال: حمض الكلوريك (HClO3) |
|
جدا مثال: النتريت |
عظم مثال: حمض النيتروز (HNO2) |
خصائص الأحماض
الخصائص الرئيسية للأحماض هي:
- طعمها لاذع.
- إنها تحمل تيارًا كهربائيًا ، لأنها محاليل إلكتروليتية.
- أنها تشكل غاز الهيدروجين عندما تتفاعل مع المعادن مثل المغنيسيوم والزنك.
- تشكل ثاني أكسيد الكربون عند التفاعل مع كربونات الكالسيوم.
- يغيرون مؤشرات القاعدة الحمضية إلى لون معين (يتحول ورق عباد الشمس الأزرق إلى اللون الأحمر).
الأحماض الأساسية
أمثلة: حمض الهيدروكلوريك (HCl) ، وحمض الكبريتيك (H2فقط4) وحمض الخليك (CH3COOH) ، وحمض الكربونيك (H2كو3) وحمض النيتريك (HNO3).

على الرغم من أن حمض الأسيتيك هو حمض من الكيمياء العضوية ، إلا أنه من المهم معرفة هيكله بسبب أهميته.
القواعد
القواعد هي مركبات أيونية تتكون من الكاتيونات ، ومعظمها من المعادن ، والتي تنفصل في الماء وتطلق أنيون الهيدروكسيد (OH-).
التصنيف الأساسي
يمكن تصنيف القواعد وفقًا لعدد الهيدروكسيل الذي يتم إطلاقه في المحلول.
| عدد الهيدروكسيل |
|---|
|
أحاديات: لديهم هيدروكسيل واحد فقط. أمثلة: NaOH و KOH و NH4أوه |
|
ديباس: يحتوي على نوعين من الهيدروكسيل. أمثلة: Ca (OH)2، Fe (OH)2 و Mg (OH)2 |
|
ترايباس: يحتوي على ثلاث هيدروكسيل. أمثلة: Al (OH)3 و Fe (OH)3 |
|
رباعيات: يحتوي على أربعة هيدروكسيل. أمثلة: Sn (OH)4 و Pb (OH)4 |
القواعد هي مواد أيونية بشكل عام وتقاس قوة القاعدة بدرجة التفكك.
كلما زادت قيمة أقوى هي القاعدة لأن:
| درجة التفكك |
|---|
|
قوي: لديهم درجة تفكك عمليا 100٪. أمثلة:
|
|
ضعيف: لديها درجة تفكك أقل من 5٪. مثال: NH4OH و Zn (OH)2. |
| الذوبان في الماء |
|---|
|
قابل للذوبان: المعادن القلوية وقواعد الأمونيوم. أمثلة: Ca (OH)2با (يا)2 و نيو هامبشاير4أوه. |
|
قابل للذوبان قليلا: قواعد معدنية ترابية قلوية. أمثلة: Ca (OH)2 وبا (أوه)2. |
|
عمليا غير قابلة للذوبان: قواعد أخرى. أمثلة: AgOH و Al (OH)3. |
التسمية الأساسية
يمكن وصف الصيغة العامة للقاعدة على أنها , حيث B يمثل الجذر الموجب الذي يشكل القاعدة و y هو الشحنة التي تحدد عدد الهيدروكسيل.
يتم إعطاء تسمية القواعد ذات الحمولة الثابتة من خلال:
| قواعد ذات حمولة ثابتة | ||
|---|---|---|
الفلزات القلوية |
هيدروكسيد الليثيوم |
LiOH |
| المعادن الأرضية القلوية | هيدروكسيد المغنيسيوم |
ملغ (يا)2 |
فضة |
هيدروكسيد الفضة |
AgOH |
| الزنك | هيدروكسيد الزنك | Zn (يا)2 |
| الألومنيوم | هيدروكسيد الألومنيوم | آل (أوه)3 |
عندما يكون للقاعدة حمولة متغيرة ، يمكن أن تكون التسمية بطريقتين:
| قواعد ذات حمولة متغيرة | |||
|---|---|---|---|
| نحاس | الحمار+ | هيدروكسيد النحاس أنا | كوه |
| هيدروكسيد النحاس | |||
| الحمار2+ | هيدروكسيد النحاس II | النحاس (أوه)2 | |
| هيدروكسيد النحاسي | |||
| حديد | إيمان2+ | هيدروكسيد الحديد II | Fe (OH)2 |
| هيدروكسيد الحديدوز | |||
| إيمان3+ | هيدروكسيد الحديد III | Fe (OH)3 | |
| هيدروكسيد الحديديك |
خصائص القواعد
- معظم القواعد غير قابلة للذوبان في الماء.
- إجراء تيار كهربائي في محلول مائي.
- هم زلقون.
- تتفاعل مع الحمض لتشكيل الملح والماء كمنتجات.
- يغيرون مؤشرات القاعدة الحمضية إلى لون معين (يتحول ورق عباد الشمس الأحمر إلى اللون الأزرق).
القواعد الرئيسية
تستخدم القواعد على نطاق واسع في منتجات التنظيف وأيضًا في عمليات الصناعة الكيميائية.
أمثلة: هيدروكسيد الصوديوم (NaOH) ، هيدروكسيد المغنيسيوم (Mg (OH)2) وهيدروكسيد الأمونيوم (NH4OH) ، هيدروكسيد الألومنيوم (Al (OH)3) وهيدروكسيد الكالسيوم (Ca (OH)2).

أملاح
أملاح هي مركبات أيونية تحتوي على كاتيون واحد على الأقل بخلاف H+ وأنيون غير OH-.
يمكن الحصول على الملح في تفاعل معادلة ، وهو تفاعل بين حمض وقاعدة.
ينتج تفاعل حمض الهيدروكلوريك مع هيدروكسيد الصوديوم كلوريد الصوديوم والماء.
يتكون الملح المتكون من أنيون الحمض (Cl-) وبواسطة الكاتيون الأساسي (Na+).
تصنيف الأملاح
أدناه ، لدينا العائلات الرئيسية للأملاح التي يمكن تصنيفها وفقًا للذوبان في الماء وتغير الأس الهيدروجيني للمحلول على النحو التالي:
| الذوبان في الماء من الأملاح الأكثر شيوعًا | |||
|---|---|---|---|
| قابل للذوبان | النترات | استثناءات: أسيتات الفضة. |
|
| كلورات | |||
خلات |
|||
| كلوريدات | استثناءات: |
||
| البروميدات | |||
| اليود | |||
| الكبريتات |
استثناءات: |
||
| لا يتحلل في الماء | كبريتيدات |
استثناءات: الأرض القلوية والأمونيوم. |
|
| كربونات | استثناءات: تلك المعادن القلوية والأمونيوم. |
||
| الفوسفات |
| الرقم الهيدروجيني | |
|---|---|
| أملاح محايدة |
عندما تذوب في الماء فإنها لا تغير درجة الحموضة. مثال: كلوريد الصوديوم. |
| الأملاح الحمضية |
عندما تذوب في الماء فإنها تجعل المحلول أقل من 7. مثال: NH4Cl. |
| أملاح أساسية |
عندما يتم إذابتها في الماء فإنها تجعل المحلول الرقم الهيدروجيني أكبر من 7. مثال: CH3كونا. |
بالإضافة إلى عائلات الملح التي رأيناها سابقًا ، هناك أنواع أخرى من الأملاح ، كما هو موضح في الجدول أدناه.
| أنواع أخرى من الأملاح | |
|---|---|
| أملاح الهيدروجين | مثال: NaHCO3 |
| أملاح الهيدروكسي | مثال: Al (OH)2Cl |
| أملاح مزدوجة | مثال: KNaSO4 |
| أملاح رطبة | مثال: CuSO4. 5 ساعات2ا |
| أملاح معقدة | مثال: [Cu (NH3)4]فقط4 |
تسمية الأملاح
بشكل عام ، تتبع تسمية الملح الترتيب التالي:
| اسم الأنيون | اسم الكاتيون | اسم الملح |
|---|---|---|
|
Cl- كلوريد |
إيمان3+ الحديد الثالث |
FeCl3 كلوريد الحديد III |
|
كبريتات |
في+ صوديوم |
في2فقط4 كبريتات الصوديوم |
|
نتريت |
ك+ البوتاسيوم |
KNO2 نتريت البوتاسيوم |
|
ر- البروميد |
هنا2+ الكالسيوم |
CaBr2 بروميد الكالسيوم |
خصائص الأملاح
- هم مركبات أيونية.
- إنها صلبة وبلورية.
- تعاني من الغليان في درجات حرارة عالية.
- إجراء التيار الكهربائي في المحلول.
- طعمها مالح.
الأملاح الرئيسية
أمثلة: نترات البوتاسيوم (KNO3) ، هيبوكلوريت الصوديوم (NaClO) ، فلوريد الصوديوم (NaF) ، كربونات الصوديوم (Na2كو3) وكبريتات الكالسيوم (CaSO4).

أكاسيد
أكاسيد هي مركبات ثنائية (أيونية أو جزيئية) تتكون من عنصرين. لديهم أكسجين في تركيبها ، وهو أكثر عناصرها كهرسلبية.
الصيغة العامة للأكسيد هي ، حيث C هو الكاتيون وتصبح شحنته y مؤشرًا في الأكسيد مكونًا المركب:
تصنيف الأكاسيد
| حسب الروابط الكيميائية | |
|---|---|
| أيوني |
مزيج من الأكسجين مع المعادن. مثال: ZnO. |
| جزيئي |
مزيج من الأكسجين مع عناصر غير معدنية. مثال: OS2. |
| حسب الخصائص | |
|---|---|
| الأساسيات |
في محلول مائي يغيرون الأس الهيدروجيني إلى أكبر من 7. مثال: قرأت2O (والمعادن الأرضية القلوية والقلوية الأخرى). |
| الأحماض |
في محلول مائي تتفاعل مع الماء وتشكل أحماض. أمثلة: CO2، فقط3 و لا2. |
| محايدون |
بعض الأكاسيد التي لا تتفاعل مع الماء. مثال: CO. |
| بيروكسيدات |
في محلول مائي تتفاعل مع الماء أو الأحماض المخففة وتشكل بيروكسيد الهيدروجين H2ا2. مثال: Na2ا2. |
| الأمفوتيرات |
يمكن أن تتصرف مثل الأحماض أو القواعد. مثال: ZnO. |
تسمية الأكاسيد
بشكل عام ، تتبع تسميات الأكسيد الترتيب التالي:
| الاسم حسب نوع الأكسيد | |
|---|---|
| أكاسيد أيونية |
أمثلة على أكاسيد الشحنة الثابتة: CaO - أكسيد الكالسيوم ال2ا3 - أكسيد الألمونيوم |
|
أمثلة على أكاسيد ذات شحنة متغيرة: FeO - أكسيد الحديد II إيمان2ا3 - أكسيد الحديد الثالث | |
| أكاسيد جزيئية |
أمثلة: CO - أول أكسيد الكربون ن2ا5 - خامس أكسيد ثنائي النيتروجين |
خصائص الأكسيد
- هم مواد ثنائية.
- تتشكل عن طريق ارتباط الأكسجين بعناصر أخرى ، باستثناء الفلور.
- أكاسيد المعادن ، عندما تتفاعل مع الأحماض ، تشكل الملح والماء.
- الأكاسيد غير المعدنية ، عند التفاعل مع القواعد ، تشكل الملح والماء.
أكاسيد رئيسية
أمثلة: أكسيد الكالسيوم (CaO) ، أكسيد المنغنيز (MnO2) وأكسيد القصدير (SnO2) ، أكسيد الحديد الثالث (Fe2ا3) وأكسيد الألومنيوم (Al2كو3).

تمارين امتحان القبول
1. (UEMA / 2015)2ونظام التشغيل2 هي الغازات التي تسبب تلوثًا جويًا يؤدي ، من بين الأضرار الناتجة ، إلى تكوين من المطر الحمضي عندما تتفاعل هذه الغازات مع جزيئات الماء الموجودة في السحب وتنتج HNO3 و ح2فقط4.
عندما تحمل هذه المركبات عن طريق هطول الأمطار في الغلاف الجوي ، فإنها تولد اضطرابات ، مثل تلوث مياه الشرب ، وتآكل المركبات ، والآثار التاريخية ، وما إلى ذلك.
تتوافق المركبات غير العضوية المذكورة في النص ، على التوالي ، مع الوظائف:
أ) الأملاح والأكاسيد
ب) القواعد والأملاح
ج) الأحماض والقواعد
د) القواعد والأكاسيد
هـ) الأكاسيد والأحماض
البديل الصحيح: هـ) الأكاسيد والأحماض.

الأكاسيد عبارة عن مركبات تتكون من الأكسجين وعناصر أخرى ، باستثناء الفلور.
عندما تتلامس الأحماض مع الماء ، فإنها تخضع للتأين وتنتج أيون الهيدرونيوم. بالنسبة للأحماض المعنية ، لدينا ردود الفعل التالية:
HNO3 إنه أحادي الحمض لأنه يحتوي على هيدروجين مؤين واحد فقط. يقوم H2فقط4 وهو ثنائي حامض لأنه يحتوي على نوعين من الهيدروجين المتأين.
تتوافق الوظائف غير العضوية الأخرى الموجودة في الأسئلة مع:
القواعد: أيونات الهيدروكسيل (OH-) مرتبطة أيونيًا بالكاتيونات المعدنية
الأملاح: نتاج تفاعل التعادل بين حمض وقاعدة.
تعلم المزيد عنوظائف كيميائية.
2. (UNEMAT / 2012) نستخدم العديد من المنتجات الكيميائية في حياتنا اليومية ، مثل حليب المغنيسيوم والخل والحجر الجيري والصودا الكاوية.
من الصحيح القول إن هذه المواد المذكورة تنتمي ، على التوالي ، إلى الوظائف الكيميائية:
أ) الحمض والقاعدة والملح والقاعدة
ب) القاعدة والملح والحمض والقاعدة
ج) القاعدة والحمض والملح والقاعدة
د) حامض وقاعدة وقاعدة وملح
ه) الملح والحمض والملح والقاعدة
البديل الصحيح: ج) القاعدة والحمض والملح والقاعدة.
يعتبر حليب المغنيسيوم والحجر الجيري والصودا الكاوية أمثلة على المركبات التي تحتوي على وظائف غير عضوية في هياكلها.
الخل مركب عضوي يتكون من حمض كربوكسيل ضعيف.
في الجدول أدناه يمكننا ملاحظة هياكل كل منها والوظائف الكيميائية التي تميزها.
| منتج | حليب المغنيسيوم | خل | حجر الكلس | الصودا الكاوية |
|---|---|---|---|---|
| سماد كيميائي | هيدروكسيد المغنيسيوم | حمض الاسيتيك | كربونات الكالسيوم | هيدروكسيد الصوديوم |
| معادلة | ||||
| الوظيفة الكيميائية | يتمركز | حمض الكربوكسيل | ملح | يتمركز |
حليب المغنيسيوم هو معلق من هيدروكسيد المغنيسيوم يستخدم في علاج حامض المعدة ، لأنه يتفاعل مع حمض الهيدروكلوريك من عصير المعدة.
الخل هو بهار يستخدم على نطاق واسع بشكل رئيسي في تحضير الطعام بسبب رائحته ونكهته.
الحجر الجيري هو صخر رسوبي ، خامه الرئيسي هو الكالسيت ، والذي يحتوي على كميات كبيرة من كربونات الكالسيوم.
الصودا الكاوية هو الاسم التجاري لهيدروكسيد الصوديوم ، وهو قاعدة قوية تستخدم في العديد من العمليات الصناعية والاستخدامات المنزلية لفك انسداد الأنابيب بسبب تراكم الزيوت والشحوم.
3. (UDESC / 2008) فيما يتعلق بحمض الهيدروكلوريك ، يمكن القول:
أ) عندما يكون في محلول مائي ، فإنه يسمح بمرور التيار الكهربائي
ب) مشيد
ج) حمض ضعيف
د) لديه درجة منخفضة من التأين
ه) مادة أيونية
البديل الصحيح: أ) عندما يكون في محلول مائي ، فإنه يسمح بمرور التيار الكهربائي.
حمض الهيدروكلوريك أحادي الحمض لأنه يحتوي على هيدروجين مؤين واحد فقط.
إنه مركب جزيئي ، ذو درجة عالية من التأين ، وبالتالي فهو حمض قوي ، عندما يتعاقد مع الماء ، يكسر جزيئه إلى أيونات على النحو التالي:
كما لاحظ أرينيوس في تجاربه ، تتحرك الأيونات الموجبة المتكونة في التأين نحو القطب السالب ، بينما تتحرك الأيونات السالبة نحو القطب الموجب.
بهذه الطريقة ، يتدفق التيار الكهربائي إلى المحلول.
لمزيد من القضايا مع القرار المعلق ، انظر أيضا: تمارين على وظائف غير عضوية.