الكبريتات هي مركبات أيونية تحتوي على أنيون SO42-، وهو ما يسمى أنيون الكبريتات.
الكبريت هو عنصر من عائلة 16 أو VI-A ، مما يعني أنه يحتوي على 6 إلكترونات في غلاف التكافؤ. وفقًا لقاعدة الثمانيات ، ستحتاج إلى تلقي إلكترونين إضافيين للحصول على 8 إلكترونات في غلاف الإلكترون الأخير وبالتالي تكون مستقرة. لكن الكبريت يخضع لتوسع ثماني ، لأنه عنصر موجود في الفترة الثالثة من الجدول الدورية ، كونها كبيرة نسبيًا ، مما يسمح لها باستيعاب أكثر من ثمانية إلكترونات حول.
وهكذا ، كما يتضح أدناه ، يتسع مستوى التكافؤ للكبريت ليضم ما مجموعه 12 إلكترونًا. لكن ذرتين من الأكسجين ما زالا غير مستقرين ، ولكل منهما سبعة إلكترونات في غلاف التكافؤ ، وبالتالي تحتاج إلى تلقي إلكترون آخر للاستقرار. لهذا السبب ، فإن شحنة كل من هاتين الذرتين هي -1 ، مما ينتج عنه شحنة إجمالية لأنيون -2:
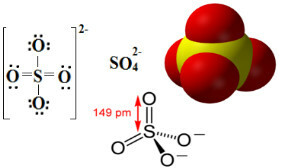
يمكن أن يأتي أنيون الكبريتات من حامض الكبريتيك (H2فقط4 (عبد القدير)) ظاهر أدناه:
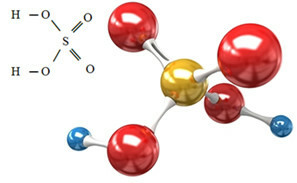
يتفاعل حمض الكبريتيك مع بعض القواعد ، في تفاعل معادل ، مكونًا ملحًا غير عضوي ، وهو كبريتاتنا ، وكذلك الماء:
تفاعل عام: حامض الكبريتيك + قاعدة → ملح (كبريتات) + ماء
ح2فقط4 + 2 جأوه →ج2فقط4+ 2 ح2ا
انظر المثال أدناه حيث تتشكل كبريتات البوتاسيوم:
ح2فقط4 + 2 كو →ك2فقط4+ 2 ح2ا
لاحظ أن تسمية الكبريتات تتم ببساطة من خلال القاعدة: كبريتات + اسم العنصر المرتبط بها. بالإضافة إلى ذلك ، يتم إجراء الصيغ الخاصة بالكبريتات عن طريق تبادل شحنة كل أيون لمؤشر العنصر ، مع عدم الحاجة إلى كتابة الفهرس "1":
أمثلة:
في+1 فقط42- → في2فقط4→ كبريتات الصوديوم
ملغ+2 فقط42- → MgSO44→ كبريتات الماغنيسيوم
هنا+2 فقط42- → قضية4→ كبريتات الكالسيوم
با+2 فقط42- → باسو4→ كبريتات الباريوم
ال+3 فقط42- → ال2(فقط4)3→ كبريتات الألومنيوم
عادة ما تكون الأملاح المحتوية على أيون الكبريت قابلة للذوبان في الماء ، والاستثناءات هي أربعة: كبريتات الكالسيوم (CaSO4) ، كبريتات السترونشيوم (SrSO4) ، كبريتات الباريوم (BaSO4) وكبريتات الرصاص (PbSO4). هذا بسبب وجود طاقة ربط عالية بين هذه الكاتيونات (Ca2+، سيدي المحترم2+، با2+ والرصاص2+) والكبريتات ، حيث تحتوي جميعها على +2 شحنة وأنيون الكبريتات بها شحنة -2. وبالتالي ، يصبح قطع هذا الاتصال أكثر صعوبة.
تم العثور على الكبريتات في شكل شبكات بلورية ، بسبب الجذب الذي تمارسه الشحنات المعاكسة على بعضها البعض ، كما هو موضح أدناه في حالة كبريتات النحاس (CuSO)4):

توجد الكبريتات في الطبيعة بشكل رئيسي في شكل معادن. انظر بعض الأمثلة:
الباريت → كبريتات الباريوم
جبس → كبريتات الكالسيوم؛
سيليستيت → كبريتات السترونشيوم
الزوايانعم → كبريتات الرصاص
الجلوبيرايت → كالسيوم مزدوج وكبريتات الصوديوم: CaNa2(فقط4)2;
شب البوتاسيوم (كالينيت) → كبريتات ألومنيوم البوتاسيوم المزدوجة المميهة: KAl (SO42.11H2ا
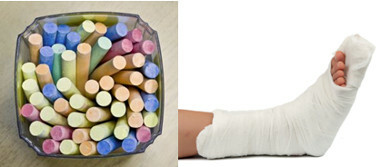
من بين الكبريتات الرئيسية في الحياة اليومية ، لدينا كبريتات الكالسيوم ، والتي تستخدم في شكل لا مائي (بدون ماء) في صناعة الطباشير المدرسية. عندما يكون في شكل ثنائي هيدرات ، (CaSO4 .2 ح2س) ، وهو معروف باسم الجبس وهو أكثر وفرة. عند التسخين ، فإنه يشكل نصف هيدرات كبريتات الكالسيوم (CaSO4. ½ح2O) وهو من الجبس يستخدم في جراحة العظام وقوالب الأسنان والبناء المدني والدهانات.
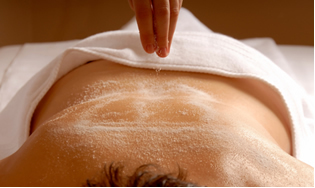
ملح آخر مهم هو sكبريتات المغنيسيوم (MgSO44) ، والمعروف باسم sملح مر أو إبسوم ، له مفعول ملين ويستخدم للتدليك وحمامات الاسترخاء.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
