الجزيء عبارة عن مجموعة من الذرات ، متشابهة أو مختلفة ، مرتبطة بروابط تساهمية.
هذه الأنواع الكيميائية متعادلة كهربائيًا وتمثل وحدة تشكيل المادة.
هناك جزيئات بسيطة مثل الأكسجين (O2) من الهواء الذي نتنفسه. ومع ذلك ، هناك أيضًا مركبات معقدة ، مثل بوكي بولز (60 ذرة كربون مرتبطة بشكل كروي) ، وهي أكبر جزيئات وجدت في الفضاء على الإطلاق.
دراسة الجزيء
يتوافق الترابط التساهمي في الجزيء مع الإلكترونات المشتركة ، عادة بين العناصر غير المعدنية.
انظر إلى جزيء الماء كمثال لمركب بسيط.
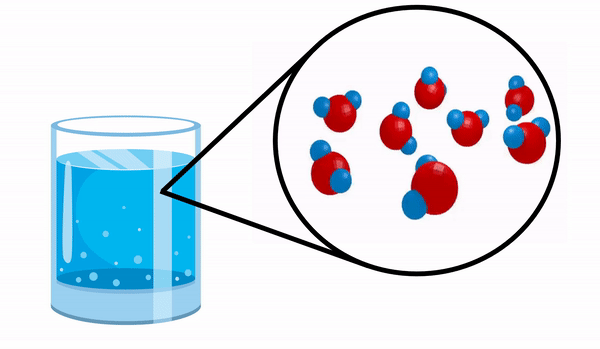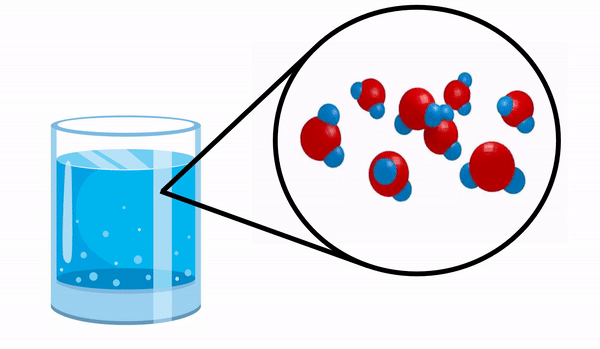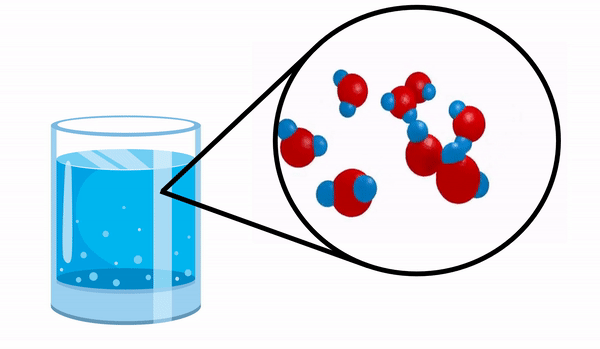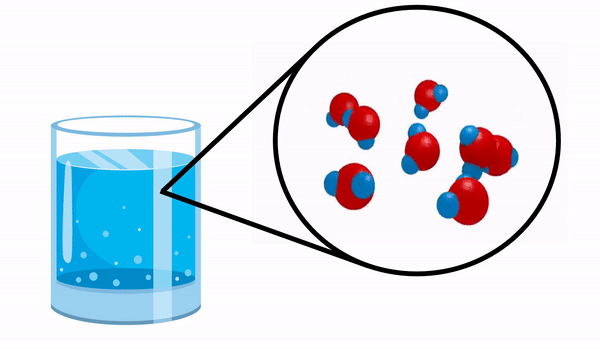
عندما نلاحظ الزجاج مع ماء ليس لدينا أي فكرة أن هذه المادة تتكون من عدة جزيئات H2س. تشير هذه الصيغة إلى أن الماء يتكون من 3 ذرات: ذرتان هيدروجين وأكسجين ، تتقاسم الإلكترونات مع بعضها البعض.
السكر ، الذي نستخدمه لتحلية العصائر وصنع الكعك ، يتكون أيضًا من جزيئات. وحدة تشكيل السكر هي السكروز.

هذا الجزيء أكثر تعقيدًا ، حيث يوجد 45 ذرات متصل. يتكون من: 12 ذرة كربون ، 22 ذرة هيدروجين و 11 ذرة أكسجين.
الجزيئات عبارة عن هياكل ذات كتلة جزيئية معروفة ، ولكن هناك أيضًا جزيئات كبيرة ، وهي "هياكل عملاقة" تتكون من العديد من الذرات لدرجة أن تكوينها غير محدد. مثال على هذا النوع هو الماس ، وهو جزيء ضخم يتكون من ذرات عديدة من
كربون في شبكة تساهمية.الرابطة التساهمية
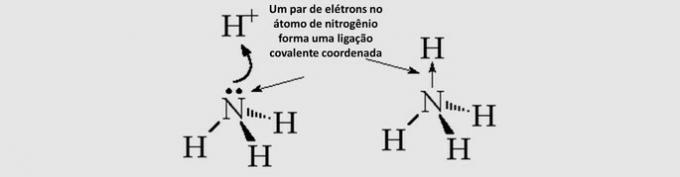
يتم إنشاء رابطة كيميائية تساهمية بين ذرتين عندما يتشاركان الإلكترونات أكثر خارجية (من التكافؤ). يمكن أن تحتوي الجزيئات على نوعين من الروابط:
الرابطة التساهمية الجزيئية: يتم مشاركة زوج إلكترونات ذرتين المترابطتين.

الرابطة التساهمية التساهمية (dative): تأتي الإلكترونات المشتركة من ذرة واحدة فقط.
الهندسة الجزيئية
عندما يتشكل الجزيء ، يتم وضع الذرات بطرق مختلفة ، بحيث يكون الترتيب المكاني أكثر استقرارًا. لذلك ، المركبات لها أشكال هندسية مختلفة.
فيما يلي بعض الأشكال الهندسية التي يمكن أن تمتلكها الجزيئات.
| الهندسة الجزيئية | ||
|---|---|---|
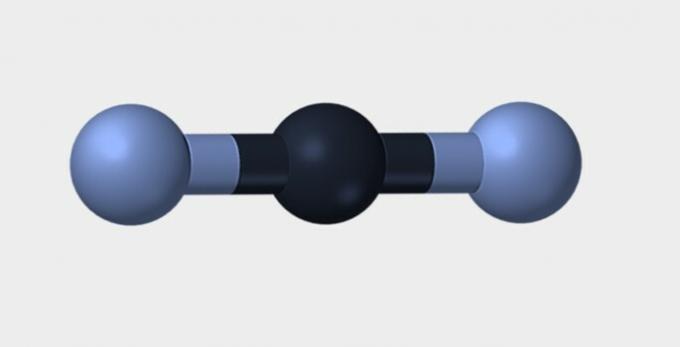
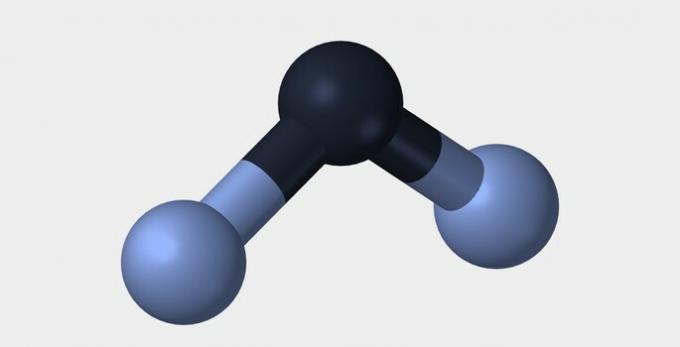
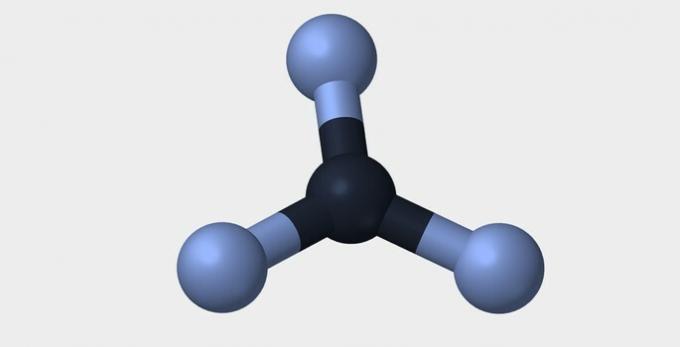
| خطي | الزاوي | الثلاثي |
 |
 |
 |
| هرمي | رباعي السطوح | ثماني السطوح |
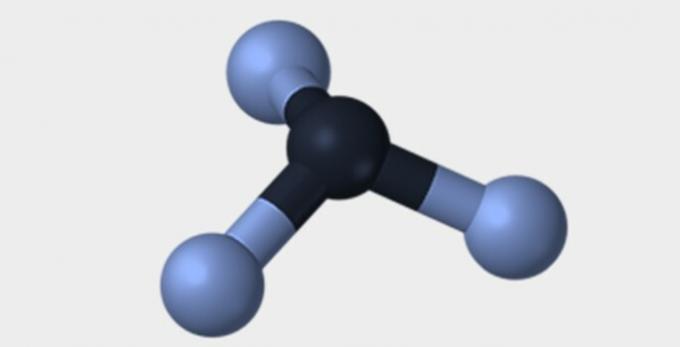 |
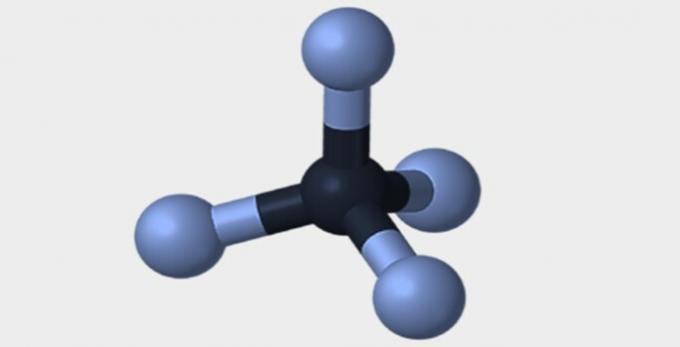 |
 |
الجزيئات القطبية وغير القطبية
يتم تصنيف الجزيئات وفقًا لـ قطبية.
جزيئات غير قطبية: لا يوجد فرق في الكهربية بين الذرات.
| نيتروجين (N2) | ثاني أكسيد الكربون (CO2) |
|---|---|
 |
 |
نيتروجين (N2) هو جزيء غير قطبي لأنه يتكون منه عنصر كيميائي وبالتالي لا يوجد فرق في الكهربية. ثاني أكسيد الكربون (CO2) غير قطبية بسبب هندستها الخطية ، والتي تعمل على استقرار جذب الأكسجين بواسطة الإلكترونات.
الجزيئات القطبية: هناك فرق في الكهربية بين الذرات ، مع قطب موجب وقطب سالب.
| الماء (H.2س) | الأمونيا (NH3) |
|---|---|
 |
 |
في كلا المثالين ، نرى أن الذرات المركزية ، الأكسجين والنيتروجين ، لها أزواج إلكترونية غير زوجية تشكل غيومًا إلكترونية. نظرًا لوجود عدد أكبر من الغيوم الإلكترونية حول الذرات المركزية أكثر من الروابط الكيميائية الراسخة ، فإن الجزيئات قطبية.
أمثلة على الجزيئات
| مستوى | سمات | مركب | معادلة |
|---|---|---|---|
| هيدروجين | وقود وفير في القشرة الأرضية. | 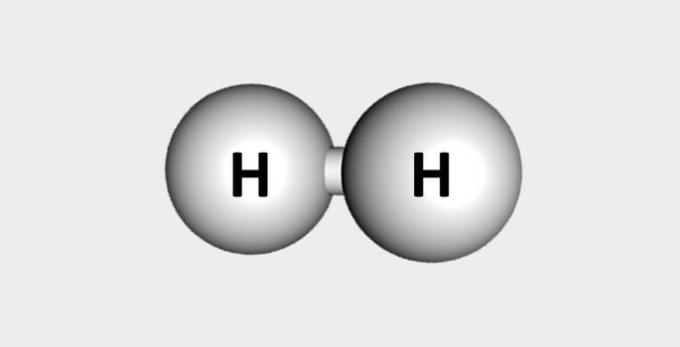 |
ح2 |
| الأكسجين | ضروري للتنفس ويشارك في التفاعلات الكيميائية المختلفة | 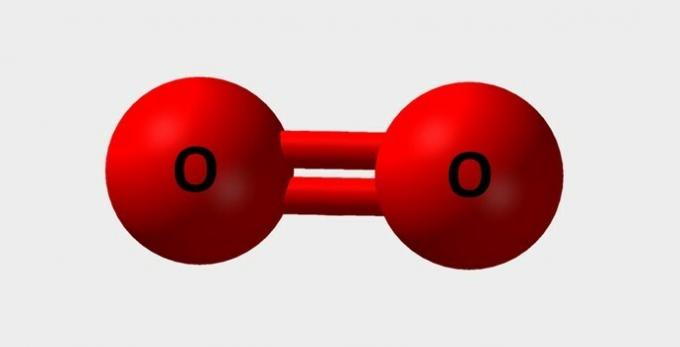 |
ا2 |
| كبريت | مسحوق أصفر يستخدم في صناعة الأصباغ. | 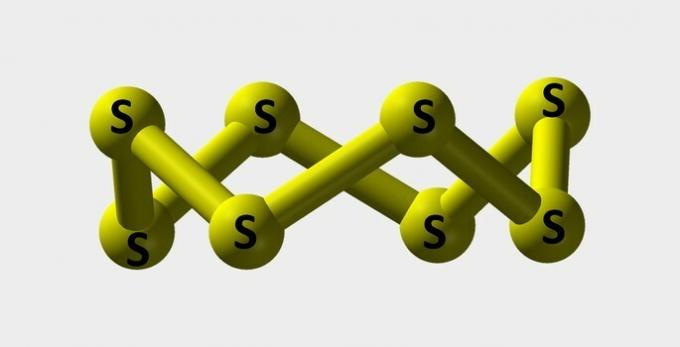 |
س8 |
| نشبع | تستخدم في طفايات الحريق وغازات التبريد. | 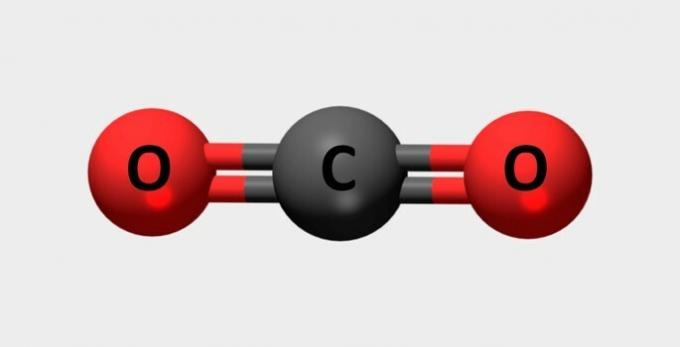 |
كو2 |
| الإيثانول | الكحول الشائع المستخدم كوقود وفي العطور. | 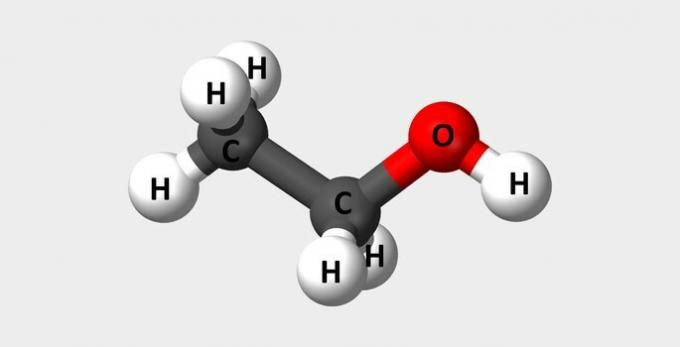 |
ج2ح6ا |
تأكد من مراجعة هذه النصوص حول الموضوعات المتعلقة بما تعلمته للتو:
- الجزيئات الحيوية
- مركبات العضوية
- الكتلة الجزيئية
- القاعدة الثماني
- روابط كيميائية
- قطبية الاتصال
- القوى بين الجزيئات
