التماثل الكيميائي هو ظاهرة يتم ملاحظتها عندما يكون لاثنين أو أكثر من المواد العضوية نفس الصيغة الجزيئية ، ولكن تختلف في التركيب الجزيئي والخصائص.
المواد الكيميائية التي لها هذه الخصائص تسمى أيزومرات.
المصطلح مشتق من الكلمات اليونانية ايزو = على قدم المساواة و مجرد = أجزاء ، أي أجزاء متساوية.
هناك أنواع مختلفة من التماكب:
- ايزومير مسطح: يتم تحديد المركبات بواسطة الصيغ الهيكلية المسطحة. وهي مقسمة إلى تزاوج متسلسل ، تماثل وظيفي ، تماثل موضعي ، تماثل تعويضي ، تماثل متماثل.
- ايزومير الفضاء: التركيب الجزيئي للمركبات له هياكل مكانية مختلفة. وهي مقسمة إلى تماثل هندسي وبصري.
ايزومير مسطح
في التماثل المسطح أو التماثل الدستوري ، فإن التركيب الجزيئي للمواد العضوية مسطح.
المركبات التي تظهر هذه الخاصية تسمى الايزومرات المسطحة.
سلسلة ايزومير
تحدث التماثل المتسلسل عندما يكون لذرات الكربون سلاسل مختلفة ونفس الوظيفة الكيميائية.
أمثلة:
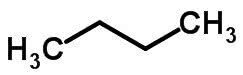
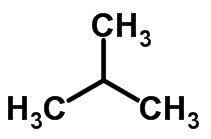
وظيفة التماثل
تحدث التماثل الوظيفي عندما يكون لمركبين أو أكثر وظائف كيميائية مختلفة ونفس الصيغة الجزيئية.
أمثلة: هذه الحالة شائعة بين الألدهيدات والكيتونات.
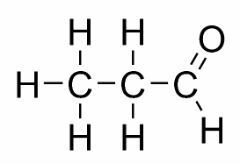
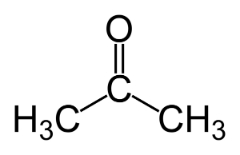
موقف الايزومر
يحدث تماثل الموضع عندما يتم تمييز المركبات عن طريق عدم تشبع مختلف أو متفرعة أو مواقع مجموعة وظيفية في سلسلة الكربون. في هذه الحالة ، يكون للأيزومرات نفس الوظيفة الكيميائية.
أمثلة:

موازنة الايزومر
يحدث التماثل التعويضي أو metamerism في المركبات التي لها نفس الوظيفة الكيميائية التي تختلف حسب موقع الذرات غير المتجانسة.
أمثلة:

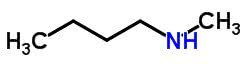
توتومري
يمكن اعتبار Tautomerism أو isomerism الديناميكي حالة محددة من التماثل الوظيفي. في هذه الحالة ، يمكن أن يتغير أيزومر إلى آخر عن طريق تغيير موضع عنصر في السلسلة.
أمثلة:

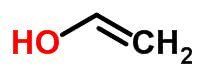
ايزومير الفضاء
ال تماثل الفضاء، وتسمى أيضًا الأيزومرية الفراغية ، تحدث عندما يكون لمركبين نفس الصيغة الجزيئية والصيغ الهيكلية المختلفة.
في هذا النوع من التماثل ، تتوزع الذرات بنفس الطريقة ، لكنها تحتل مواقع مختلفة في الفضاء.
ايزومر هندسي
ال تماثل هندسي أو cis-trans يحدث في السلاسل المفتوحة غير المشبعة وكذلك في المركبات الحلقية. للقيام بذلك ، يجب أن تكون روابط الكربون مختلفة.

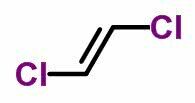
- عندما تكون نفس الروابط على نفس الجانب ، فإن تسمية الأيزومير تتلقى البادئة رابطة الدول المستقلة.
- عندما تكون نفس الروابط على جوانب متقابلة ، تتلقى التسمية البادئة عبر.
يوصي الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) باستخدام الحرفين Z و E كبادئة بدلاً من cis و trans.
هذا لأن Z هو الحرف الأول من الكلمة الألمانية zusammen، وهو ما يعني "معًا". وهو الحرف الأول من الكلمة الألمانية انتيجن، وهو ما يعني "العكس".
الايزومر البصري
ال التماثل البصري يتضح من خلال المركبات النشطة بصريًا. يحدث ذلك عندما تكون المادة ناتجة عن الانحراف الزاوي في مستوى الضوء المستقطب.
- عندما تنحني مادة ما الضوء البصري إلى اليمين فإنها تسمى أيمن.
- عندما تنحني مادة بصرية إلى اليسار ، تسمى المادة ليفوروتاري.
يمكن أن توجد المادة أيضًا في شكلين نشطين بصريًا ، dextogyra و levogyra. في هذه الحالة ، يتم استدعاؤه متماثل.
لكي يكون مركب الكربون نشطًا بصريًا ، يجب أن يكون حلزونيًا. هذا يعني أن روابطهم لا يمكن أن تتداخل ، كونها غير متماثلة.
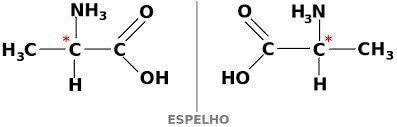
في المقابل ، إذا كان المركب يحتوي على أشكال ديكستروجيرا و ليفوروتاري في أجزاء متساوية ، يتم استدعاؤها مخاليط راسيمية. النشاط البصري للخلائط الراسيمية غير نشط.
اقرأ أيضا:
- كربون
- الكيمياء العضوية
- الصيغة الجزيئية
- الصيغة الهيكلية
تمارين
1. (Mackenzie 2012) العمود B ، الذي يحتوي على مركبات عضوية ، ويربطها بالعمود A ، وفقًا لنوع التماثل الذي يقدمه كل جزيء عضوي.
العمود أ
1. موازنة الايزومر
2. ايزومر هندسي
3. سلسلة ايزومير
4. الايزومر البصري
العمود ب
() البروبان الحلقي
() إيثوكسي إيثان
() برومو كلورو فلورو ميثان
() 1،2-ثنائي كلورو-إيثين
التسلسل الصحيح للأرقام في العمود B من أعلى إلى أسفل هو
أ) 2 - 1 - 4 - 3.
ب) 3 - 1 - 4 - 2.
ج) 1 - 2 - 3 - 4.
د) 3-4-1-2.
هـ) 4-1 - 3 - 2.
البديل ب) 3 - 1 - 4 - 2.
2. (Uerj) Isomery هي الظاهرة التي تتميز بحقيقة أن نفس الصيغة الجزيئية تمثل تراكيب مختلفة.
النظر في التماثل الهيكلي المسطح للصيغة الجزيئية C4ح8يمكننا التعرف على الايزومرات من الأنواع التالية:
أ) السلسلة والموقف
ب) السلسلة والوظيفة
ج) الوظيفة والتعويض
د) المنصب والتعويض
البديل أ) السلسلة والموقع
3. (OSEC) يمثل البروبانون والأيزوبروبينول حالة من التماكب:
أ) الميتامريا
ب) الوظيفة
ج) من الحشو
د) رابطة الدول المستقلة
ه) سلسلة
البديل ج) من الحشو
نرى أيضا: تمارين على الايزومرية المسطحة


