التحليل الكهربائي هي عملية فيزيائية كيميائية تستخدم الطاقة الكهربائية من أي مصدر (مثل البطارية أو البطارية) لإجبار حدوث تفاعل كيميائي لإنتاج مواد بسيطة أو مركبة لا يمكن العثور عليها في الطبيعة أو لا توجد بكميات كبيرة.
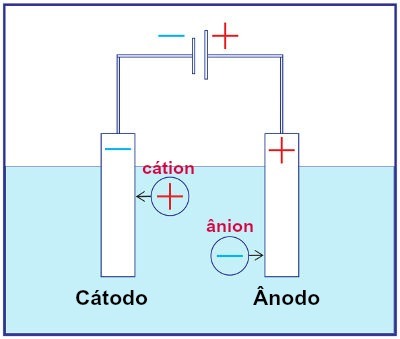
تمثيل تجميع أي نظام تحليل كهربائي
أثناء التحليل الكهربائي ، يخضع الكاتيون للاختزال عند الكاثود ، ويخضع الأنيون للأكسدة عند الأنود. يحدث هذا من خلال التفريغ الكهربائي الذي يوفره مصدر خارجي. وهكذا ، في التحليل الكهربائي ، لدينا تفاعل أكسدة واختزال غير تلقائي.
افهم الآن الطريقتين اللتين يحدث بهما التحليل الكهربائي:
في هذا النوع من التحليل الكهربائي ، نستخدم أ مادة أيونية في الحالة السائلة في وعاء إلكتروليتي. عندما تخضع المادة الأيونية (XY) للانصهار ، فإنها تخضع لعملية التفكك، على النحو المبين أدناه:
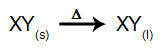

ثم ، عند تشغيل مصدر الطاقة ، فإن الكاتيون (X+) يتحرك نحو الكاثود ، والأنيونات (Y-) التحرك نحو الأنود. بذلك:
عند الكاثود: تستقبل الكاتيونات الإلكترونات (تخضع للاختزال) وتتحول إلى مادة مستقرة (X) ، وهي عملية ممثلة بالمعادلة التالية:
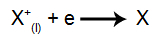
عند الأنود: تفقد الأنيونات الإلكترونات (تخضع للأكسدة) وتصبح مادة مستقرة (X) ، وهي عملية ممثلة بالمعادلة التالية:

أ) مثال على التحليل الكهربائي البركاني
كمثال ، اتبع الآن التحليل الكهربائي البركاني لـ كلوريد الصوديوم (كلوريد الصوديوم). عندما يخضع كلوريد الصوديوم للانصهار ، فإنه يخضع لعملية التفكك ، كما هو موضح أدناه:
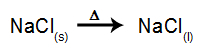
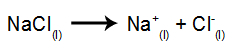
ثم ، عند تشغيل مصدر الطاقة ، الكاتيون (Na+) يتحرك نحو الكاثود ، والأنيونات (Cl-) التحرك نحو الأنود. بذلك:
عند الكاثود: الكاتيونات في+ يتلقون إلكترونات (تخضع للاختزال) ويصبحون مادة مستقرة (Na ، وهو معدن صلب) ، وهي عملية ممثلة بالمعادلة أدناه:

عند الأنود: الأنيونات Cl- يفقدون الإلكترونات (يخضعون للأكسدة) ويصبحون مادة مستقرة (Cl2، وهي غازية) ، تمثلها المعادلة أدناه:

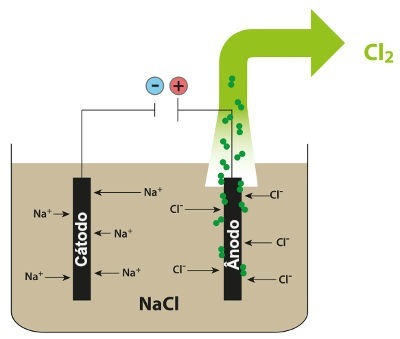
مخطط يوضح التحليل الكهربائي البركاني لكلوريد الصوديوم
وهكذا ، في التحليل الكهربائي البركاني لكلوريد الصوديوم ، يكون لدينا تكوين الصوديوم المعدني (Na) وغاز الكلور (Cl2).
في هذا النوع من التحليل الكهربائي ، نستخدم مادة أيونية مذابة في الماء داخل خزان التحليل الكهربائي. لذلك ، قبل إجراء التحليل الكهربائي ، نقوم أولاً بخلط المادة (عادةً ملح غير عضوي) في الماء للتسبب في تفككه (إطلاق كاتيون وأنيون) ، كما هو موضح أدناه:
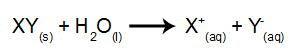
الفرق فيما يتعلق بالتحليل الكهربائي البركاني هو أنه بالإضافة إلى الأيونات الناتجة عن التفكك ، لدينا أيضًا أيونات من التأين الذاتي للماء. في التأين الذاتي ، ينتج الماء كاتيون الهيدرونيوم (H+) وأنيون هيدروكسيد (OH-) ، كما في المعادلة أدناه:

وهكذا ، داخل وعاء التحليل الكهربائي ، لدينا وجود اثنين من الكاتيونات (واحد من المادة أيوني وواحد من الماء) واثنين أنيون (أحدهما من المادة الأيونية والآخر من ماء).
لمعرفة أي الكاتيون سينتقل إلى القطب السالب وأي الأنيون سينتقل إلى القطب الموجب ، من الضروري معرفة ترتيب تصريف الكاتيونات والأنيونات.
للكاتيونات:
Au> Pt> Hg> Ag> Cu> Ni> Cd> Pb> Fe> Zn> Mn> الهيدرونيوم> عائلة IIIA> عائلة IIA> عائلة IA
للأنيونات
الأنيونات غير المؤكسجة و H SO4 > هيدروكسيد> الأنيونات المؤكسجة و F
ثم ، عندما يتم تشغيل مصدر الطاقة ، الكاتيون (X+) يتحرك نحو الكاثود ، وواحد من الأنيونات (Y-) يتحرك نحو الأنود.
عند الكاثود: تستقبل الكاتيونات الإلكترونات (تخضع للاختزال) وتتحول إلى مادة مستقرة (X) ، وهي عملية تمثلها المعادلة أدناه:

عند الأنود: تفقد الأنيونات الإلكترونات (تخضع للأكسدة) وتصبح مادة مستقرة (Y) ، وهي عملية ممثلة بالمعادلة أدناه:
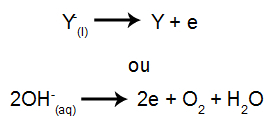
أ) مثال على التحليل الكهربائي المائي
كمثال ، سوف نستخدم التحليل الكهربائي المائي لكلوريد الصوديوم (NaCl). عندما يذوب كلوريد الصوديوم (NaCl) في الماء ، فإنه يخضع لعملية التفكك ، كما هو موضح أدناه:
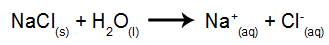
بالإضافة إلى تفكك كلوريد الصوديوم ، لدينا التأين الذاتي للماء:

لذلك لدينا الكاتيونات H+ و على+ وأنيونات OH- و Cl-. بعد ذلك ، عند تشغيل مصدر الطاقة ، لدينا ما يلي:
في الكاثود: الكاتيونات H.+ استقبال الإلكترونات (مخفضة) وتصبح مادة مستقرة (H2وهو غاز). هذا لأن الهيدرونيوم له أولوية تفريغ على عناصر عائلة IA (في هذه الحالة ، Na). يتم تمثيل العملية بالمعادلة أدناه:
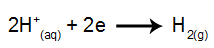
في الأنود: الأنيونات Cl- يفقدون الإلكترونات (يخضعون للأكسدة) ويصبحون مادة مستقرة (Cl2وهو غازي). هذا لأن Cl- إنه أنيون غير مؤكسج وله أولوية تفريغ على الهيدروكسيد ، وهي عملية ممثلة بالمعادلة أدناه:


مخطط يوضح التحليل الكهربائي المائي لكلوريد الصوديوم
وهكذا ، في التحليل الكهربائي المائي لكلوريد الصوديوم ، لدينا تكوين غاز الهيدروجين (H2) وغاز الكلور (Cl2).
بي ديوغو لوبيز دياس
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletrolise.htm



