* نظرية أرهينيوس:
بناء على تجاربه في الموصلية الكهربائية في الوسط المائي الكيميائي والفيزيائي والرياضي اقترح السويدي Svante August Arrhenius (1859-1927) ، في عام 1884 ، المفاهيم التالية لتعريف الأحماض و القواعد:

لذلك ، بشكل عام ، لدينا:
ح+ + ح2O → H.3ا+
أمثلة:
حمض الهيدروكلوريك + ح2O → H.3ا++ Cl-
HNO3+ ح2O → H.3ا+ + لا3-
ح2فقط4+ 2 ح2O → 2H3ا+ + نظام التشغيل42-

أمثلة:
NaOH → Na + + أوه-
كاليفورنيا (يا)2 → كاليفورنيا2+ + 2 أوه-
* نظرية برونستيد لوري:
بشكل مستقل ، الدنماركي يوهانس نيكولاس برونستيد (1879-1947) والإنجليزي توماس مارتن لوري (1874-1936) ، اقترح في نفس العام نظرية أخرى حمضية قاعدية تعرف باسم نظرية برونستيد-لوري ، والتي تقول التالية:

في هذه الحالة ، يعتبر أيون الهيدروجين بروتونًا. يظهر هذا في التفاعل التالي ، حيث يتبرع حمض الهيدروسيانيك ببروتون للماء ، والذي يعمل بالتالي كقاعدة:
HCN + ح2O → CN- + ح3ا+
هذا التفاعل قابل للعكس ، مع أيون الهيدرونيوم (H3ا+) يمكن التبرع ببروتون لأيون CN-. وهكذا ، فإن أيون الهيدرونيوم (H3ا+) بمثابة حمض و CN- كقاعدة.
CN- + ح3ا+→ HCN + H.2ا
* نظرية لويس:
ابتكر هذه النظرية الكيميائي الأمريكي جيلبرت نيوتن لويس (1875-1946) وتقول ما يلي:

تقدم هذه النظرية مفهومًا جديدًا ، وهو أكثر شمولاً ، لكنها لا تبطل نظرية برونستيد-لوري. كل حمض لويس هو حمض برونستيد ، وبالتالي فإن كل قاعدة لويس هي قاعدة برونستيد. وذلك لأن البروتون يستقبل الإلكترونات ، مما يعني أن حمض لويس يمكن أن ينضم إلى زوج وحيد من الإلكترونات في قاعدة لويس.
بالنسبة إلى لويس ، يتكون تفاعل القاعدة الحمضية من تكوين رابطة تساهمية منسقة أكثر استقرارًا. لذلك عندما تتبرع قاعدة لويس بزوج من الإلكترونات لقاعدة لويس ، فإن كلاهما يشكلان a تنسيق الرابطة التساهمية ، حيث يأتي كلا الإلكترونين من إحدى الذرات ، كما في المثال أدناه:
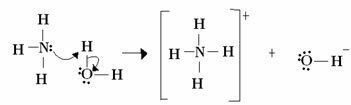
في هذه الحالة ، تعمل الأمونيا كقاعدة لويس وبرونستد ، حيث تتبرع بإلكترونين لها للبروتون وبالتالي فهي مستقبل البروتون. بالإضافة إلى ذلك ، تم تكوين رابطة تساهمية بين الهيدروجين (البروتون) والأمونيا.
الماء هو حمض لويس وحمض برونستيد ، لأنه يتبرع بالبروتون ويستقبل الإلكترونات ، لاحظ كيف أن الأكسجين الموجود في الهيدروكسيد المتكون من الماء يحتوي على زوج إضافي من الإلكترونات.

بقلم جينيفر فوغاسا
تخرج في الكيمياء
فريق مدرسة البرازيل.
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm