الأسترة هي تفاعل كيميائي قابل للعكس بين حمض الكربوكسيل والكحول ، ينتج الإستر والماء.
يمكن وصف التفاعل على النحو التالي:
حمض الكربوكسيل + الكحول → استر + ماء
يكون تفاعل الأسترة بطيئًا ، ويتطلب زيادة في درجة الحرارة ووجود محفز لتسريع سرعته. هذه العملية تسمى استرة فيشر.
يسمى رد الفعل العكسي للأسترة إستر التحلل المائي. في هذه الحالة ، يتم إنتاج حمض الكربوكسيل والكحول من الإستر والماء.
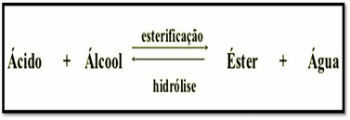
تفاعلات الأسترة
المعادلة العامة لتفاعل الأسترة هي كما يلي:
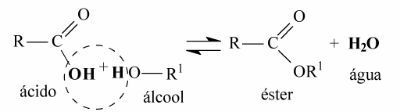
لاحظ أن الماء يتكون من اتحاد مجموعة الهيدروكسيل (OH) لحمض الكربوكسيل مع الهيدروجين (H) للكحول.
يتحد ما تبقى من سلسلة الكربون لحمض الكربوكسيل والكحول معًا لتشكيل الإستر.
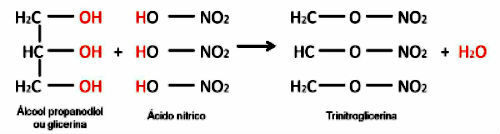
يمكن أن يحدث الأسترة أيضًا بين حمض غير عضوي أو كحول ثانوي أو ثالث.
في هذه الحالة ، سيحدث تكوين الماء بطريقة مختلفة: ستأتي مجموعة الهيدروكسيل من الكحول والهيدروجين من الحمض.
مثال على ذلك هو التفاعل بين حمض غير عضوي وتكوين استر غير عضوي. تتفاعل الجزيئات الثلاثة للحمض العضوي (حمض النيتريك) مع الجلسرين وتشكل ثلاثي نيتروجليسرين (إستر النترات) ، وهو مادة متفجرة.
التطبيقات
الحصول على الإسترات مهم لإنتاج أنواع مختلفة من المنتجات. انظر بعض الأمثلة:
المنكهات في الصناعات الغذائية
أسترة فيشر هي الوسيلة الرئيسية لإنتاج الإسترات في المنشآت الصناعية ، وخاصة المواد الغذائية.
المنكهات عبارة عن استرات تعطي رائحة ونكهة للمنتجات الصناعية مثل الحلوى والحلويات والمشروبات الغازية والعصائر.
أمثلة على الإسترات المستخدمة كمنكهات هي:
- إيثيل إيثانوات: رائحة التفاح
- octyl ethanoate: رائحة البرتقال
- إيثيل بوتانوات: رائحة الأناناس
وقود الديزل الحيوي
يتم الحصول على وقود الديزل الحيوي من خلال تفاعل الأسترة.
تتكون العملية من خلط الزيت النباتي أو الدهون الحيوانية (الدهون الثلاثية) في ميثانول أو إيثانول ، في وجود محفز.
أحد منتجات التفاعل هو الجلسرين ، والذي يمكن استخدامه في صناعة مستحضرات التجميل والأطعمة والأدوية.
اقرأ أيضا:
- تفاعل التحويل
- تفاعل التعادل
- تفاعل التصبن: التحلل المائي للإستر