يتعامل القانون الثالث للديناميكا الحرارية مع سلوك المادة مع إنتروبيا تقترب من الصفر.
وفقًا لهذا القانون ، عندما يكون النظام في حالة توازن ديناميكي حراري ، تقترب إنتروبيا من الصفر.
يتعلق القانون الثاني للديناميكا الحرارية بالانتروبيا. بعد ذلك ، يظهر القانون الثالث على أنه أ محاولة لتأسيس نقطة مرجعية مطلقة تحدد الانتروبيا.
كان والثر نرنست (1864-1941) الفيزيائي الذي تعامل مع المبادئ التي شكلت الأساس للقانون الثالث للديناميكا الحرارية.
وفقًا لنيرنست ، فإن الإنتروبيا تميل إلى أن يكون لها قيمة دنيا إذا كانت درجة حرارة مادة نقية مساوية أو تقترب من الصفر المطلق.
لذلك ، اقترح Nernst الصيغة أدناه ، والتي توضح أن تباين الانتروبيا (ΔS) ودرجة الحرارة (T) تميل إلى القيم الدنيا ، أي 0:
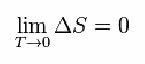
لكن ما هو الانتروبيا؟
غير قادر علي إنها الطريقة التي تنظم بها الجزيئات نفسها في النظام. يترجم هذا التنظيم إلى اضطراب ، ليس بمعنى الارتباك ، ولكن بمعنى حركة الجزيئات وإثارةها.
كلما زادت الجزيئات التي يمكن أن تتحرك ، كلما كانت غير منظمة ، زادت إنتروبياها.
في البداية ، اقترح نيرنست أن الانتروبيا التي اقترحها لن تكون ممكنة إلا على بلورات كاملة.
أخيرًا ، خلص إلى أن درجة الحرارة التي تساوي الصفر المطلق لم تكن موجودة ، مما يجعل القانون الثالث قانونًا مثيرًا للجدل.
لذلك ، بالنسبة للعديد من الفيزيائيين ، هذا ليس قانونًا ولكنه قاعدة.
بعد سنوات عديدة (منذ عام 1912) ، يحاول العلماء الحصول على درجة الحرارة هذه أو درجات الحرارة التي تقترب أكثر فأكثر من الصفر المطلق. وهكذا ، اكتشفوا أنه من الممكن فقط في الغازات ، التخلص من أي مادة في الحالة الصلبة أو السائلة.
اقرأ أيضا:
- القانون الصفري للديناميكا الحرارية
- القانون الأول للديناميكا الحرارية
- القانون الثاني للديناميكا الحرارية
- تمارين في الديناميكا الحرارية