الكلور عنصر كيميائي برمز Cl ، العدد الذري 17 ، الكتلة الذرية 35.5. إنه ينتمي إلى عائلة الهالوجين ، المجموعة 17 أو 7 أ ، وإلى الفترة الثالثة من الجدول الدوري.
اسمها مشتق من اليونانية خلوروس، وهو ما يعني مخضر. هذا لأنه في ظل الظروف العادية لدرجة الحرارة والضغط ، يتميز الكلور بأنه غاز أصفر مخضر ورائحة قوية.
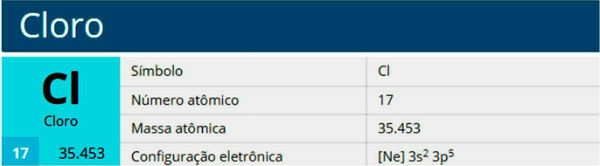
سمات
تم اكتشاف الكلور في عام 1774 من قبل العالم السويدي كارل فيلهلم شيل (1742-1786). ومع ذلك ، في ذلك الوقت كنت أعتقد أنه مركب يحتوي على الأكسجين. في عام 1810 ، أظهر همفري ديفي (1778-1829) أنه عنصر كيميائي جديد.
نظرًا لأنه عنصر شديد التفاعل ، فإنه نادرًا ما يوجد في الطبيعة في شكله النقي ، باستثناء الكمية الصغيرة المنبعثة أثناء الانفجارات البركانية في شكل حمض الهيدروكلوريك.
وبالتالي ، يوجد بشكل شائع في شكل كلوريد الصوديوم (NaCl) ، المعروف أيضًا باسم ملح الطعام. في المعادن ، يحدث في شكل كارناليت وسيلفيت.
يمكن الحصول عليها أيضًا عن طريق التحليل الكهربائي من كلوريد الصوديوم ، في محلول مائي. ينتج الكلور أيضًا العديد من الأملاح من الكلوريدات خلال عملية أكسدة.
تعرف على المزيد ، اقرأ أيضًا:
- الجدول الدوري
- العناصر الكيميائية
- الهالوجينات
التطبيقات
غاز الكلور (Cl2) سامة ومزعجة ، أدت هذه الحالة إلى استخدامها كسلاح كيميائي خلال الحرب العالمية الأولى. يسبب هذا الغاز تهيجًا في الجهاز التنفسي والجلد ، واحتباس الماء في الرئتين ، والتمزق ، وعند استنشاقه بكميات كبيرة يمكن أن يؤدي إلى الوفاة.
بعض الاستخدامات الأخرى للكلور هي:
- تبييض الورق والأقمشة باستخدام ثاني أكسيد الكلور (ClO2).
- معالجة المياه بإضافة الكلور تجعل المياه صالحة للشرب وصالحة للاستهلاك الآدمي. تسمى هذه العملية بالكلور وتستخدم حمض هيبوكلوروس (HClO).
- تطهير مياه حمامات السباحة والمخلفات الصناعية ، حيث أن الكلور قادر على قتل الكائنات الحية الدقيقة.
- إنتاج مركبات بلاستيكية مثل PVC (بولي فينيل كلورايد) والمطاط الصناعي.
- إنتاج بعض أنواع المركبات العضوية وغير العضوية.


