المركبات العضوية جزيئية ، أي أن ذراتها تحمل روابط تساهمية مع بعضها البعض. عندما نحلل الروابط بين الكربون ، والتي يمكن أن تكون مفردة أو مزدوجة أو ثلاثية ، نلاحظ أنها كذلك روابط غير قطبية ، حيث لا يوجد فرق في الكهربية بين الذرات ، لأنها تنتمي إلى نفس جزء.
علاوة على ذلك ، نظرًا لأن الهيدروجين والكربون لهما فرق صغير جدًا في الكهربية ، فإن الروابط بينهما أيضًا غير قطبية.
اتصالات غير قطبية:
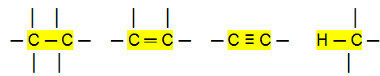
مع ذلك ، يمكننا أن نستنتج أن ملف الهيدروكربونات (مركبات عضوية تحتوي فقط على ذرات كربون وهيدروجين) هي جزيئات غير قطبية. في هذه المركبات ، يكون التفاعل بين الجزيئات من النوع ثنائي القطب المستحث ، وهو الأضعف الموجود.
نظرًا لضعف هذه التفاعلات ، فمن السهل كسرها. ونتيجة لهذا، درجات حرارة غليان وانصهار الهيدروكربونات أقل من تلك الخاصة بالوظائف الأخرى.

مقارنة الهيدروكربونات ، ستزداد نقاط الغليان مع زيادة الكتلة المولية أيضًا.
على سبيل المثال ، الإيثان والبيوتان كلاهما ألكانات. شاهد نقاط الغليان لكل تم تحديدها تجريبياً:
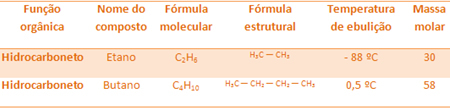
لاحظ أن درجة غليان البيوتان أعلى بكثير من درجة غليان الإيثان ، حيث أن كتلته المولية أعلى أيضًا.
الآن عندما نقارن الهيدروكربونات التي لها نفس الكتلة المولية (وهي أيزومرات) ، ولكن لها أنواع مختلفة من سلاسل الكربون ، فإننا ندرك ذلك
كلما زاد عدد الفروع ، انخفضت درجة حرارة الغليان، لأن هيكل الجزيء يصبح أكثر إحكاما ، أي أن سطحه يتناقص.جميع الألكانات الموجودة أدناه لها نفس الصيغة الجزيئية ، C5ح12، لكن درجات غليانها مختلفة:
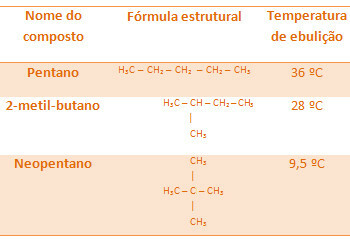
لاحظ أن درجة حرارة غليان النيوبنتين هي الأدنى نظرًا لوجود عدد أكبر من الفروع.
يمكننا اعتبار أن الوظائف العضوية الأخرى مشتقة من الهيدروكربونات ، من خلال استبدال واحد أو أكثر من الهيدروجين بذرات أو مجموعات من ذرات عناصر أخرى. بشكل عام ، تحتوي الوظائف العضوية الأخرى على أكسجين أو نيتروجين ، وهي عناصر كهرسلبية أكثر من الكربون. إنها تجذب بقوة أكبر زوج الإلكترونات المشتركة مع الكربون ، وبالتالي تجعل الجزيء قطبيًا:
التوصيلات القطبية:
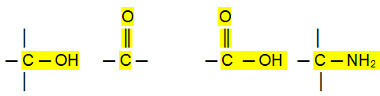
الألدهيدات والكيتونات والهاليدات العضوية لها نقاط غليان أعلى من الهيدروكربونات ، لأن تفاعلها بين الجزيئات هو ثنائي القطب الدائم ، وهو أقوى من تفاعل ثنائي القطب الناجم.
من ناحية أخرى ، تحتوي الكحوليات والأحماض الكربوكسيلية والأمينات على درجات حرارة غليان أعلى ، لأنها تنفذ روابط هيدروجينية ، وهي أكثر أنواع التفاعل بين الجزيئات كثافة.
في مركبات كل هذه الوظائف ، نفس الشيء ينطبق على الهيدروكربونات:

بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/polaridade-temperatura-ebulicao-dos-compostos-organicos.htm