العدد الكتلي (ممثلة بالحرف الكبير أ) هي التسمية المستخدمة لتحديد الكمية البروتونات و النيوترونات موجودة داخل نواة أي ذرة (يمثلها الاختصار X).
عندما نمثل العدد الكتلي من أي ذرة ، الطريقة الصحيحة لكتابتها هي أعلى الجانب الأيمن أو الأيسر من اختصار الذرة ، كما نرى في النمط العام أدناه:

نماذج تمثيل العدد الجماعي
يتم إعطاء عدد البروتونات في الذرة بواسطة العدد الذري (Z) ، والتي يتم وضعها دائمًا على يسار اختصار الذرة ، في الجزء السفلي.
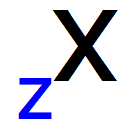
تمثيل العدد الذري بالأحرف الأولى من أي ذرة
مثل العدد الكتلي تشير دائمًا إلى كمية البروتونات (p) والنيوترونات (n) داخل النواة ، تم إنشاء صيغة بناءً على هذا التعريف:
أ = ص + ن
من هذا التعبير الرياضي ، لدينا شرط لتحديد:
العدد الكتلي: بناءً على عدد البروتونات وعدد النيوترونات ؛
عدد البروتونات: بناءً على العدد الكتلي وعدد النيوترونات ، إعادة كتابة المعادلة على النحو التالي:
ع = أ - ن
عدد النيوترونات: بناءً على العدد الكتلي وعدد البروتونات ، إعادة كتابة المعادلة على النحو التالي:
ن = أ - ص
المثال الأول: تحديد عدد النيوترونات الموجودة في نواة ذرة الكلور ، 17Cl35.
في البيان ، لدينا قيمتان في الاختصار ، واحدة في الجزء السفلي الأيسر ، وهي العدد الذري أو عدد البروتونات ، والأخرى أعلاه ، وهي عدد الكتلة:
Z أو p = 17
أ = 35
لتحديد عدد النيوترونات ، ما عليك سوى استخدام القيم الواردة في التعبير المستخدم لحساب الكتلة الذرية ، مع إعادة كتابتها على النحو التالي:
ن = أ - ص
ن = 35 - 17
ن = 18
المثال الثاني: ما عدد البروتونات الموجودة داخل نواة ذرة سكانديوم ، إذا كان عددها الكتلي وعدد النيوترونات ، على التوالي ، 43 و 21؟
يوفر التمرين قيمتين ، العدد الكتلي والعدد النيوتروني. هكذا:
أ = 43
ن = 21
لتحديد عدد البروتونات ، ما عليك سوى استخدام القيم الواردة في التعبير المستخدم لحساب الكتلة الذرية ، وإعادة كتابتها كما يلي:
ع = أ - ن
ص = 43-21
ص = 22
المثال الثالث: ما هو عدد كتلة ذرة لها عدد ذري يساوي 60 ولها 88 نيوترونًا داخل نواتها؟
يعطي التمرين قيمتين ، العدد الذري (أو عدد البروتونات) وعدد النيوترونات. هكذا:
Z أو p = 60
ن = 88
لتحديد عدد النيوترونات ، ما عليك سوى استخدام القيم الواردة في التعبير المستخدم لحساب العدد الكتلي:
أ = ص + ن
أ = 60 + 88
أ = 148
بي ديوغو لوبيز دياس
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-numero-massa.htm

