الهيدروكربونات ، وتسمى أيضًا كربيدات الهيدروجين، هي مركبات عضوية يتكون تركيبها من ذرات فقط كربون (ج) ومن هيدروجين (H) ، وبالتالي الحصول على الصيغة العامة Cxحذ.
يتكون الهيدروكربون من بنية كربونية ترتبط بها ذرات الهيدروجين الرابطة التساهمية.
إنه أهم مركب في الكيمياء العضوية.
تتأكسد جميع أنواع الهيدروكربونات بسهولة ، وبالتالي تطلق الحرارة. معظمهم غير قابل للذوبان في الماء.
الهيدروكربونات الطبيعية هي مركبات كيميائية تتكون داخل الأرض (أكثر من 150 كم من العمق) عند الضغط العالي والوصول إلى مناطق الضغط المنخفض من خلال العمليات الجيولوجية.
أين توجد الهيدروكربونات؟
المصدر الرئيسي للهيدروكربون هو النفط. وبسبب هذا ، فإن الهيدروكربون موجود في العديد من المشتقات مثل الكيروسين, البارافين, غاز طبيعي, الغازولين, فازلين, زيت الديزل, غاز البترول المسال (غاز البترول المسال)، البوليمرات (مثل البلاستيك والمطاط) ، من بين أمور أخرى.
يشكل هذا المركب العضوي 48٪ من مصفوفة الطاقة في البرازيل.
سلسلة الكربون التي تشكل جزءًا من تكوين الهيدروكربون هي رباعي التكافؤ، أي أنه يمكن أن يصنع أربعة اتصالات.
الكربون قادر على الارتباط مع ذرات كربون أخرى ومع الهيدروجين من خلاله روابط بسيطة, الزوجي أو ثلاث مرات.
تصنيف المحروقات
يعتمد تصنيف المحروقات على ثلاث خصائص: أ شكل من سلسلة الكربون الرئيسية روابط سلاسل الكربون وجود جذور ألكيل في سلسلة الكربون و وجود ذرات غير متجانسة تقسيم سلسلة الكربون.
معرفة المزيد عن هيدروجين.
شكل سلسلة الكربون الرئيسي
فيما يتعلق بشكل سلسلة الكربون الرئيسية ، ينقسم تصنيف الهيدروكربونات إلى أليفاتية و دوري.
تحقق مما يتكون كل شكل من أشكال سلسلة الكربون هذه.
الهيدروكربونات الأليفاتية
تتكون الهيدروكربونات الأليفاتية من سلاسل الكربون افتح أو لا دوري. في هذه السلاسل ، تعتبر الكربون محطات طرفية.
أمثلة:
ألكان
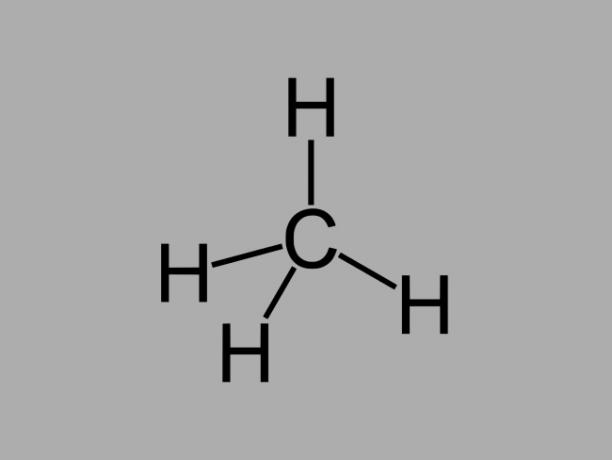
الهيدروكربونات الألكانية ، وتسمى أيضًا البارافينات أو برافيني، هي مركبات زيتية حيث لا يوجد سوى روابط مفردة بين الكربون.
الصيغة العامة للألكان هي CلاH2لا + 2 (ن = أي عدد صحيح).
ألكين
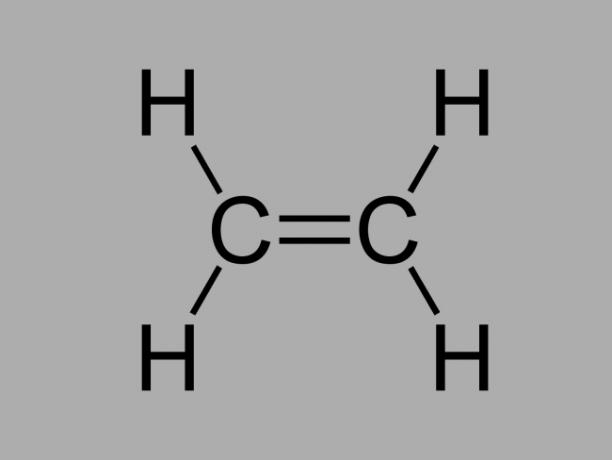
وتسمى أيضا أوليفين, ألكين أو هيدروكربون الإيثيلين، الألكين مركب ضعيف التفاعل حيث يوجد رابطة مزدوجة بين الكربون.
الصيغة العامة للألكين هي CلاH2لا.
ألكين
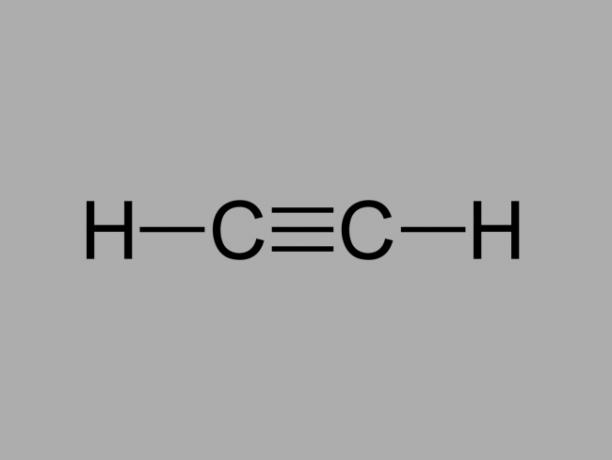
وتسمى أيضا ميثيل الأسيتيلين، alkyne عبارة عن هيدروكربون حيث تكون الروابط الموجودة بين الكربون ثلاثية.
الصيغة العامة للألكين هي CلاH2لا-2.
الكاديين

يُطلق عليه أيضًا اسم dienes أو diolefins ، والألكاديين عبارة عن هيدروكربونات حيث تكون الروابط بين ذرات الكربون مزدوجة.
الصيغة العامة للكادين هي CلاH2لا-2.
الهيدروكربونات الحلقية
تتكون الهيدروكربونات الحلقية من سلاسل كربون مغلقة أو دورية. لا تحتوي هذه السلاسل على كربون طرفي.
أمثلة:
سيكلان
وتسمى أيضا سيكلو ألكان, سيكلوبرافين أو الهيدروكربونات النفثينية، السيكلان هو هيدروكربون مشبع ، يتكون من روابط مفردة.
لها سلسلة كربون مغلقة وصيغتها العامة هي CلاH2لا.
إعصاري

وتسمى أيضا ألكينات حلقيّة، الأعاصير عبارة عن هيدروكربونات غير مشبعة تتكون من روابط مزدوجة.
يحتوي cyclene على سلسلة كربون مغلقة وصيغته العامة هي CلاH2لا−2.
دراج
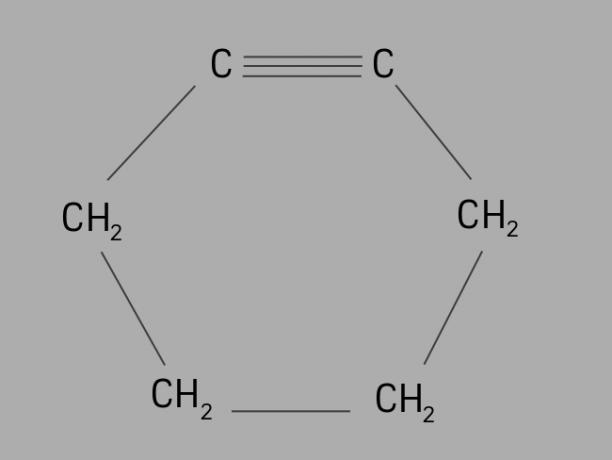
وتسمى أيضا سيكلوالكين أو سيكلوالكين، السيكلين هو هيدروكربون دوري وغير مشبع.
يتكون من سلسلة كربون مغلقة ، مع روابط ثلاثية وصيغته العامة هي CلاH2لا-4.
عطرية

أو

وتسمى أيضا الساحات، الهيدروكربونات العطرية عبارة عن مركبات غير مشبعة تتكون من روابط مزدوجة.
العطرية لها سلسلة كربون مغلقة أو دائرية وصيغتها العامة هي C6ح6.
نوع الترابط في سلاسل الكربون
اعتمادًا على نوع ارتباط سلاسل الكربون ، يمكن تصنيف الهيدروكربونات إلى مشبع أو غير مشبع.
انظر أدناه مما يتكون كل من هذه التصنيفات.
الهيدروكربونات المشبعة
تتشكل الهيدروكربونات المشبعة بواسطة روابط بسيطة.
أمثلة: الألكانات ، الأعاصير.
الهيدروكربونات غير المشبعة
تتشكل الهيدروكربونات غير المشبعة بواسطة سندات مزدوجة أو ثلاث مرات.
أمثلة: ألكينات ، ألكينات ، ألكاديين.
وجود جذور ألكيل
فيما يتعلق بوجود جذور الألكيل ، يمكن أن تحتوي الهيدروكربونات على سلسلة كربون عادي أو متفرعة.
سلسلة الكربون العادية
لا يحتوي الهيدروكربون العادي لسلسلة الكربون على جذور ألكيل.
مثال: البنتان
سلسلة الكربون المتفرعة
عندما يحتوي الهيدروكربون على سلسلة كربون متفرعة ، فهذا يعني أن سلسلة الكربون الرئيسية بها جذور ألكيل.
مثال: ميثيلبروبان
وجود ذرات غير متجانسة تقسم سلسلة الكربون
قد تنقسم أو لا تنقسم سلسلة الكربون المتسلسلة اعتمادًا على وجود ذرات غير متجانسة.
سلسلة كربون متجانسة
عندما يحتوي الهيدروكربون على سلسلة كربون رئيسية متجانسة ، فهذا يعني أن هذه السلسلة لا ينقسم عن طريق الذرات غير المتجانسة.
سلسلة كربون غير متجانسة
إذا كان الهيدروكربون يحتوي على سلسلة كربون رئيسية غير متجانسة ، فإن هذه السلسلة لها سلسلة الكربون المنقسمة بواسطة ذرة مغايرة.
تسمية الهيدروكربونات
يتم تحديد تسمية الهيدروكربونات من خلال مجموعة من ثلاثة أجزاء:

تحدد البادئة كمية الكربون ، وتحدد الوسيطة نوع الرابطة ، وتشير اللاحقة إلى الوظيفة التي ينتمي إليها المركب (في هذه الحالة ، فئة الهيدروكربونات).
انظر أدناه للحصول على قائمة البادئات والوسائط التي يتم دمجها لتعيين الهيدروكربونات.
قائمة البادئة
| عدد ذرات الكربون | اختصار |
|---|---|
| 1 | التقى- |
| 2 | إلخ- |
| 3 | دعم- |
| 4 | لكن- |
| 5 | مكبوت- |
| 6 | عرافة- |
| 7 | سبت- |
| 8 | أكتوبر- |
| 9 | عدم- |
| 10 | ديسمبر- |
قائمة الوسطاء
| نوع الاتصال | وسيط |
|---|---|
| مكالمات فردية فقط | -ان- |
| زوج | -ن- |
| ثلاثي | -في- |
| زوجان | -دين- |
انظر إلى بعض الأمثلة على تسمية الهيدروكربونات.
أمثلة:
CH3 - CH2 - CH2 - CH3
في الشكل الهيكلي أعلاه ، يمكننا أن نرى مركبًا رباعي الكربون له روابط مفردة فقط (يشار إليها بالرمز "-").
- بادئة 4 كربون = لكن-
- وسيط للربط الفردي = -an-
- لاحقة الهيدروكربون = -o
نرى أن اتحاد بادئة + وسيطة + لاحقة يؤدي إلى الاسم البيوتان.
CH2 = CH2
يحتوي الشكل الهيكلي أعلاه على 2 ذرات كربون ورابطة مزدوجة واحدة (يشار إليها بالرمز "=").
- بادئة 2 ذرات كربون = et-
- وسيط للسندات المزدوجة = -en-
- لاحقة الهيدروكربون = -o
نرى أن اتحاد بادئة + وسيطة + لاحقة يؤدي إلى الاسم اثين.
CH2 = CH - CH2 - CH3
CH3 - CH = CH2 - CH3
لاحظ أن كلا الشكلين الهيكليين أعلاه يحتويان على 4 ذرات كربون ورابطة مزدوجة واحدة (يشار إليها بالرمز "=").
وهكذا لدينا:
- بادئة 4 كربون = لكن-
- وسيط للسندات المزدوجة = -en-
- لاحقة الهيدروكربون = -o
نرى أن اتحاد بادئة + وسيطة + لاحقة من شأنه أن يؤدي إلى الاسم بوتين للشكلين الهيكليين.
ومع ذلك ، لاحظ أن الأشكال الهيكلية ليست متطابقة ، لذلك لا يمكن أن تكون التسميات أيضًا.
يكمن الاختلاف بين الشكلين الهيكليين في موقع الرابطة المزدوجة.
في هذه الحالة ، يجب علينا ترقيم الكربون في السلسلة من النهاية الأقرب إلى الضعف. لذلك ، في الحالات المذكورة ، يجب علينا الترقيم من اليسار إلى اليمين.
في CH2 = CH - CH2 - CH3:
- CH2 سيكون 1
- سيكون CH هو 2
- CH2 سيكون 3
- CH3 سيكون 4
نلاحظ أن رابطة مزدوجة يقع بين الكربون 1 انها ال الكربون 2.
يجب أن نستخدم أصغر رقم (1) لإيجاد الرابطة المزدوجة: بوتين -1
في CH3 - CH = CH2 - CH3:
- CH3 سيكون 1
- سيكون CH هو 2
- CH2 سيكون 3
- CH3 سيكون 4
لاحظ أن الرابطة المزدوجة تقع بين الكربون 2 انها ال الكربون 3.
يجب أن نستخدم أصغر رقم (2) لإيجاد الرابطة المزدوجة: BUTENE -2
بالنسبة الى IUPAC (الاتحاد الدولي للكيمياء البحتة و التطبيقية - الاتحاد الدولي للكيمياء البحتة والتطبيقية) ، يجب الإشارة إلى الموقع قليلاً قبل يجري تحديد موقعها (في حالة الصيغ الهيكلية أعلاه ، الرابطة المزدوجة ، ممثلة بالوسيط "-en-").
مع ذلك ، لدينا طريقة ثانية ، وهي بالمناسبة هي الأصح ، لكتابة تسميات الأشكال الهيكلية المتاحة.
CH2 = CH - CH2 - CH3: BUTENE -1 أو BUT-1-ENO (النموذج الأكثر صحة)
CH3 - CH = CH2 - CH3: BUTENE -2 أو BUT-2-ENE (شكل أكثر صحة)
تعلم المزيد عن IUPAC و التسمية.


