الانتروبيا هو عظمةالديناميكا الحرارية مرتبط ب اللارجعة من حالات النظام الفيزيائي. وعادة ما يرتبط بدرجة "اضطراب" أو "العشوائية"من النظام. بحسب احدى تصريحات القانون الثاني للديناميكا الحرارية:
“في النظام المعزول حرارياً ، يجب أن يزيد قياس الإنتروبيا بمرور الوقت ، حتى الوصول إلى قيمته القصوى ".
وبعبارة أخرى ، فإن ملف غير قادر علي قادر على قياس معنى "سهم الوقت"من النظام. عندما نرى الصور أدناه ، نعلم بشكل بديهي أن الحالة الأولية للنظام يتم تمثيلها بواسطة صورة غادر، من أعظم منظمة:
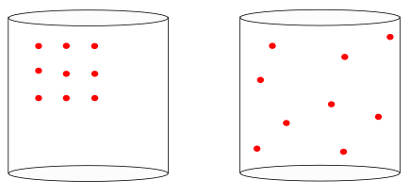
بالنظر إلى الصورة السابقة ، نعلم أن التكوين النهائي الأكثر احتمالًا هو التكوين الذي توجد فيه الذرات سرعات في كل الاتجاهات، إلى جانب مواقف عشوائية. هذا ما هو كل شيء عن الانتروبيا: أ تعدد من حالات النظام يجب أن تزيد دائما.
أمثلة
أي من الإعدادات أدناه هو أكثر احتمالا ليتم ملاحظتها لترتيب الطوب مع مرور الوقت؟

في التكوين الأول ، ملف تعدد من دول الكتل القليل: كلها مرتبة في اتجاهعرضي, موازى بعضهم البعض. مع مرور الوقت أو عمل الوكيل ، من المتوقع أن يكون تكوينه تصرف بنضج في عدد في تنص على، لصالح الاثنينالتشكل، موضح في الصورة على اليمين. يمكن إعطاء أمثلة أخرى:
-
عندما يتم وضع كيس ثلج في وعاء به أكبردرجة الحرارة، ترتفع درجة حرارته حتى تصل إلى التوازن الحراري. عند هذه النقطة ، يمكن أن يذوب الجليد. عن طريق أخذ الحرارة مرة أخرى من كتلة الجليد ، والتي هي الآن في الحالة سائل يمكن أن تصبح صلبة مرة أخرى ، ولكن شكلها لن يكون لها نفس المنظمة التي قدمت سابقا.
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
عندما نفتح زجاجة عطر ، يمكن أن تساعد الحرارة في ذلك تعريف من الخاص بك الجزيئات نشر محتويات العطر على كامل طول الغرفة. لا يمكن توقع العكس ، لأن إزالة الحرارة لن تعزز عودة الجزيئات إلى القارورة.
التعريف الرياضي للإنتروبيا
ال التعريف الرياضي من الانتروبيا من نسبة كمية الحرارة (س) المنقولة بين جزأين من نظام معزول حرارياً ، في جول (J) ، حسب درجة حرارته المطلقة ، في كلفن (ك):

س = الانتروبيا (J / K)
س = مقدار الحرارة (J)
تي = درجة الحرارة المطلقة (ك)
التعريف الوارد أعلاه صالح لـ عمليات متساوية الحرارة، أي حيث توجد تبادلات حرارية صغيرة جدًا (أو بطيئة) بحيث لا يمكنها تغيير درجة حرارة النظام. لذلك فإن تعريف الإنتروبيا هو متناهي الصغر (جزء صغير بلا حدود).
يمكننا أيضًا فهم مفهوم الانتروبيا على النحو التالي: كونه نظامًا يتكون من جزأين من نفس الغاز ، في العديد من الاختلافاتدرجات الحرارة، فمن الممكن استخراج كمية من الشغل منه يتحرك البعض مكبس أو كرنك اليد ، على سبيل المثال. ومع ذلك، متأخر، بعد فوات الوقت، سوف تميل أجزاء هذا الغاز إلى الرصيدحراري. إذا لم يعد هناك اختلاف في درجة الحرارة ، حتى مع وجود كل الطاقة الموجودة هناك ، فلن يكون من الممكن استخراج أي منها الشغلمفيد منه.
بقلم رافائيل هيلربروك
تخرج في الفيزياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
هيلربروك ، رافائيل. "ما هو الانتروبيا؟" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-entropia.htm. تم الوصول إليه في 28 يونيو 2021.

