يمكن أن يحدث أن هناك أحماض من نفس العنصر ، وهذا العنصر له نفس رقم الأكسدة (NOX) ، ولكن الاختلاف في درجات الماء.
على سبيل المثال ، أدناه ، لدينا ثلاثة أحماض مكونة من عنصر الفوسفور (P):
ح3غبار4 ح4ص2ا7 HPO3
لاحظ أن عدد أكسدة الفوسفور في جميع الأحماض الثلاثة هو +5 ؛ الاختلاف في درجة الترطيب.
بناءً على ذلك ، يتم تمييز هذه الأحماض في التسمية من خلال البادئات ortho و pyro و meta.
أكثر حمض رطب يسمى أورثو. في المثال المعطى ، الأول (H3غبار4) يسمى حامض أورثوفوسفوري، لأنه الأكثر ترطيبًا من بين الثلاثة. البادئة ortho قابلة للاستهلاك ، لذلك في معظم الأحيان يتم استدعاء هذا الحمض للتو حمض الفسفوريك.
يتم استخدام البادئات pyro و meta مع ortho acid كنقطة مرجعية:
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
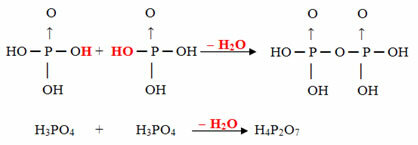
- Pyrus: جزيئين من ortho ناقص جزيء واحد من H.2ا
مثال: حرف H4ص2ا7 يسمى حامض بيروفوسفوري لأنه يساوي جزيئين من حامض الفوسفوريك (H3غبار4) ناقص جزيء ماء واحد.
2. ح3غبار4 = ح6ص2ا8
ح6ص2ا8 - ح2يا = ح4ص2ا7
هذه العملية هي أ الجفاف بين الجزيئات:
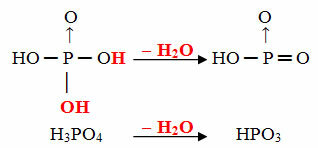
- الهدف: 1 جزيء ortho ناقص 1 جزيء H2ا
مثال: HPO3 يسمى حامض هدففوسفوري لأنه يساوي جزيء حامض الفوسفوريك (H3غبار4) ناقص جزيء ماء واحد.
ح3غبار4 - ح2O = HPO3
هذه العملية هي أ الجفاف داخل الجزيء:
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "درجة ترطيب الأحماض" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm. تم الوصول إليه في 28 يونيو 2021.
يحتوي حمض الفوسفوريك على الصيغة الجزيئية التالية: H3غبار4. من هناك ، حدد البديل الذي يشير إلى حمض البيروفوسفوريك وحمض الميتافوسفوريك ، على التوالي:
درجة التأين ، حمض الهيدروكلوريك ، التطاير ، حمض الخليك ، Svante Arrehenius ، الأحماض إجراء الكهرباء ، تفاعلات التعادل ، التفاعل مع الكربونات والبيكربونات ، محلول الفينول فثالين الأحمر ، ورق عباد الشمس أزرق.