في محلول مشبع من كلوريد الفضة (AgCl) ، على سبيل المثال ، ترد أدناه معادلة التفكك الأيوني لهذا الملح في وسط مائي:
AgCl(س) ↔ حج+(هنا) + Cl-(هنا)
إذا أضفنا محلولًا مائيًا من حمض الهيدروكلوريك (HCl) إلى هذا المحلول المشبع ، فيمكننا ملاحظة تكوين راسب كلوريد الفضة ، لأن ، كما قيل ، سيكون المحلول مشبعًا ، وبالتالي ، سيكون لديه بالفعل الحد الأقصى من AgCl الذي يمكن إذابته في هذا الحجم من الماء وعند درجة الحرارة بيئة.
يمكن قول الشيء نفسه عن Ag الأيونات+(هنا) و Cl-(هنا); لديهم أعلى تركيز ممكن من جزيء / لتر.
يتم إعطاء تفكك حمض الهيدروكلوريك في الوسط المائي بالمعادلة التالية:
حمض الهيدروكلوريك(هنا) ↔ ح+(هنا) + Cl-(هنا)
لاحظ أن أيون الكلوريد (Cl-(هنا)) هو الأيون الشائع للتوازن. وهكذا ، عند إضافة حمض الهيدروكلوريك ، يزداد تركيز الكلور.-(هنا). وفقا ل مبدأ Le Chatelier:

هذا يعني أنه مع إضافة أيونات الكلوريد ، فإنها ستكون زائدة في النظام الذي سوف يفضل التحول من التوازن إلى اتجاه استهلاكهم ، أي في اتجاه رد الفعل إلى اليسار ، للتفاعل العكسي ، مع تكوين راسب AgCl(س).
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
من المهم ملاحظة أن التأثير الأيوني المشترك يؤثر فقط على إزاحة تفاعل التوازن ، ولكن
لا يغير ثابت التوازن (K.ç), طالما ظلت درجة الحرارة ثابتة لأنها لا تتأثر إلا بالتغير في درجة الحرارة.علاوة على ذلك، يمكن أيضًا تغيير الرقم الهيدروجيني للمحلول: مع إزاحة التوازن إلى اليسار ، تنخفض درجة تأين الحمض أو القاعدة.
على سبيل المثال ، إذا أضفنا أسيتات الصوديوم (NaCH3COO) في محلول مائي من حمض الأسيتيك المخفف (CH3COOH) ، سيكون تحول التوازن إلى اليسار ، لأن الأيون المشترك ، في هذه الحالة ، هو أيون الأسيتات (CH3سجع-(هنا)). يجب استهلاك هذه الأيونات لتشكيل حمض غير مؤين.
انظر كيف يحدث ذلك من خلال تحليل تفكك أسيتات الصوديوم وحمض الخليك بشكل منفصل:
- ناخ3سجع(س) ↔ في+(هنا) + CH3سجع-(هنا)
- CH3COOH(هنا) ↔ ح+(هنا) + CH3سجع-(هنا)
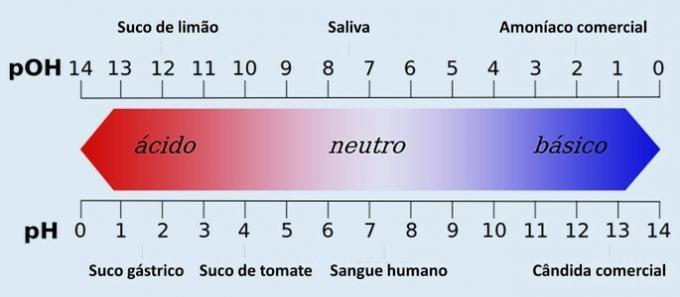
انظر كيف أيون الأسيتات هو أيون مشتركيؤدي التحول في التوازن إلى استهلاكها وانخفاض درجة تأين حمض الأسيتيك. لذلك ، يتسبب التأثير الأيوني الشائع في انخفاض تركيز أيونات الهيدروجين+(هنا)، زيادة قيمة الرقم الهيدروجيني.
يوضح تأثير الأيونات الشائعة العمليات الكيميائية والفيزيائية المهمة
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "تأثير أيون مشترك" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/efeito-ion-comum.htm. تم الوصول إليه في 28 يونيو 2021.
كيمياء

اختبر معلوماتك وتعلم المزيد مع هذه القائمة من التمارين التي تم حلها على الموازين الكيميائية. من خلال هذه المادة ، ستكون قادرًا على فهم كيفية عمل ثوابت التوازن (Kp و Kc و Ki) بشكل أفضل ، وتحول التوازن ، ودرجة الحموضة و pOH ، وكذلك التوازن في ما يسمى بالحلول العازلة.