بطارية إنه نظام يتم فيه تحويل الطاقة الكيميائية تلقائيًا إلى طاقة كهربائية.
في عام 1836 ، بنى الكيميائي وعالم الأرصاد الجوية الإنجليزي جون فريدريك دانييل (1790-1845) كومة مختلفة عن تلك المعروفة في ذلك الوقت: كومة أليساندرو فولتا. في هذه الكومة هو قطبان مترابطان ، وهما نظامان يتكونان من معدن مغمور في محلول مائي من ملح يتكون من كاتيونات هذا المعدن.
يتكون أحد الأقطاب الكهربائية ، وهو القطب النحاسي ، من صفيحة نحاسية مغموسة في محلول كبريتات النحاس (CuSO4). كان القطب الآخر عبارة عن قطب كهربي من الزنك ، يتكون من صفيحة زنك مغمورة في محلول كبريتات الزنك (ZnSO4).
تم ربط هذين القطبين بواسطة دائرة كهربائية تحتوي على مصباح ، لأنه إذا تم تشغيله ، فسيشير ذلك إلى ظهور تيار كهربائي.
أيضا ، كان هناك جسر ملح بينهما. يتكون هذا الجسر من أنبوب زجاجي على شكل حرف U يحتوي على محلول مائي مركز من ملح شديد الذوبان ، مثل كلوريد البوتاسيوم (KCl (aq)) ، على سبيل المثال. نهايات الأنبوب مطلية بالقطن أو أجار.
يوجد أدناه هيكل هذه الخلية أو الخلية الكهروكيميائية ، والتي أصبحت تعرف باسم خلية دانييل. تذكر أن كل قطب كهربائي يسمى نصف خلية.
مع إغلاق الدائرة ، يضيء المصباح وبعد مرور بعض الوقت ، تآكلت صفيحة الزنك وتناقصت كتلتها ، في حين أن الصفيحة النحاسية هي عكس ذلك ، تزداد كتلتها (كما هو موضح في الشكل أدناه). ويلاحظ أيضا أن هناك زيادة في التركيز في مول / لتر من أيونات الزنك2+ وانخفاض في أيونات النحاس2+.
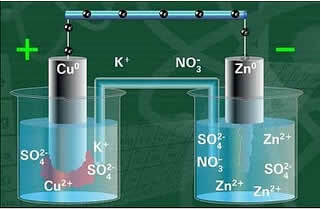
مخطط مكدس دانييل.
لماذا يحدث هذا؟
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
لفهم ذلك ، دعونا نلقي نظرة على التفاعلات التي تحدث في كل قطب على حدة.
في القطب الكهربائي الزنك ، يحدث تفاعل التوازن التالي:
Zn (s) ↔ Zn2+(هنا) + 2 و-
هذا يعني أن الزنك المعدني (من الصفيحة) يخضع للأكسدة ، أي أنه يتبرع بإلكترونين إلى كاتيون الزنك (من المحلول) ويصبح Zn2 +. يحدث العكس أيضًا ، حيث يتلقى كاتيون الزنك الموجود في المحلول الإلكترونين اللذين تبرع بهما الزنك ويصبحان زنكًا معدنيًا. لذلك ، هناك عملية مستمرة للأكسدة والاختزال.
الأمر نفسه ينطبق على القطب النحاسي ، الذي سيكون له التفاعل الشامل في التوازن الديناميكي: Cu (s) ↔ Cu2+(هنا) + 2 و-
أدرك دانييل أنه إذا قام بتوصيل هذين القطبين ، فإن الأكثر تفاعلًا سوف يتبرع بإلكتروناته إلى الكاتيونات الأقل تفاعلًا بدلاً من القيام بذلك مع الكاتيونات الموجودة في محلولها الخاص. في هذه الحالة ، يكون الزنك هو الأكثر تفاعلًا ويخضع للأكسدة ، ويتبرع بالإلكترونات للنحاس ، ومن ثم تقل كتلته. القطب الذي يخضع للأكسدة هو القطب السالب ، ويسمى القطب الموجب. القطب النحاسي هو الذي يخضع للاختزال ، ويستقبل الكاتيون النحاسي الإلكترونين من الزنك ، ويسمى القطب السالب (القطب الموجب).
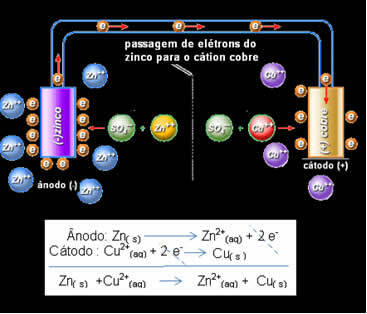
مرور الإلكترون ومعادلة دانييل العالمية.
أعلاه لدينا المعادلة العامة لهذا المكدس ، والتي يتم الحصول عليها عن طريق إضافة اثنين من ردود الفعل النصفية. يتم تمثيلها أو تدوينها الكيميائي وفقًا للقاعدة التالية:

لذلك بالنسبة لمكدس دانييل لدينا:
الزنك / الزنك2+// الحمار2+ / الحمار
بقلم جينيفر فوغاسا
تخرج في الكيمياء
فريق مدرسة البرازيل
فيزيائية كيميائية - كيمياء - مدرسة البرازيل
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "دانيل بايل" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. تم الوصول إليه في 28 يونيو 2021.


