لكي تفهم ظاهرة التأين من الضروري أولاً معرفة ما هي الأيونات. لاحظ الشرح أدناه:
كل ذرة لها نفس عدد البروتونات والإلكترونات. لذلك ، كل ذرة متعادلة كهربائيًا. علاوة على ذلك ، فإن المواد التي تتكون من مجموعات من الذرات لها أيضًا توازن شحنة كهربائية ، كونها محايدة كهربائيًا.
ومع ذلك، يمكن لذرة أو مجموعة ذرات أن تفقد أو تكتسب إلكترونات ؛ عندما يحدث ذلك ، فإنها تفقد الحياد وتصبح أيونات.
إذا فقدت الذرة أو مجموعة الذرات الإلكترونات ، فستكون موجبة الشحنة وستكون أيونًا يسمى الكاتيون. ومع ذلك ، إذا اكتسبت إلكترونات ، فستكون الشحنة سالبة وسيكون الأيون a أنيون.
المواد غير العضوية أيونية أو لديها القدرة على تكوين أيونات.
تتمثل إحدى طرق تكوين الأيونات في وضع المواد الجزيئية في الماء ، أي التي تتكون من الروابط التساهمية ، والتي يتم فيها مشاركة الإلكترونات.
على سبيل المثال ، إذا اختبرنا التوصيل الكهربائي لحمض الهيدروكلوريك (HCl) في محلول مائي (كلوريد الهيدروجين مذاب في الماء) ، سنرى أن المحلول إلكتروليتي ، أي أنه يوصل تيارًا كهربائيًا ، لأن هناك أيونات في هذا المحلول.

هذا يعني أن الماء يعمل كمفاعل ، مكونًا أيونات من حمض الهيدروكلوريك. يحدث هذا وفقًا لرد الفعل أدناه:
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
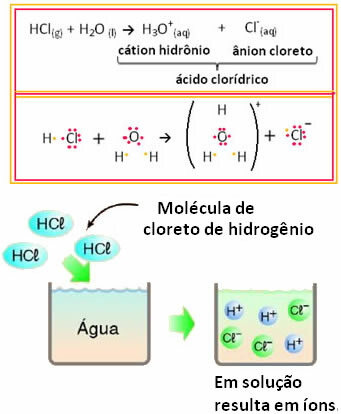
لاحظ أنه قبل وضع كلوريد الهيدروجين في الماء ، لم تكن هناك أيونات. ومع ذلك ، فقد تفاعلت جزيئاته مع الماء وشكلت أيونات H موجبة3ا+ (الكاتيونات) والسلبيات Cl- (الأنيونات). نظرًا لأن الكلور أكثر كهرسلبية من الهيدروجين ، فإنه يجذب زوج الإلكترونات من الرابطة التساهمية القريبة منه ويشكل الأنيون. من ناحية أخرى ، ينجذب الهيدروجين إلى الأكسجين الموجود في الماء ، وهو أكثر كهرسلبية من الكلور ؛ وبين الهيدروجين والأكسجين ، يتم تكوين رابطة تساهمية ، مما يؤدي إلى ظهور كاتيون الهيدرونيوم. تسمى ظاهرة تكوين الأيونات هذهالتأين.
بناءً على الشرح أعلاه ، يمكننا تعريف التأين على النحو التالي:

لاحظ أن الأيونات لم تكن موجودة من قبل ، لأنها إذا كانت موجودة ، كما في حالة انحلال المركبات الأيونية ، فسنحصل على تفكك أيوني وليس تأين.
تخضع جميع الأحماض الموضوعة على اتصال مع الماء للتأين. ومع ذلك ، لا يخضع كل مركب جزيئي للتأين.على سبيل المثال ، السكر (سي12ح22ا11) جزيئي ، ومع ذلك ، عند وضعه في الماء ، لا تتشكل أيونات ، إنه يذوب فقط ، وينشأ محلول جزيئي غير إلكتروليتي ، والذي لا يوصل الكهرباء.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "التأين" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/ionizacao.htm. تم الوصول إليه في 28 يونيو 2021.