ال المحتوى الحراري للتكوين، وتسمى أيضا المحتوى الحراري القياسي للتكوين، أو الحرارة القياسية للتكوين، هو حساب الحرارة المنبعثة أو الممتصة في تكوين مول واحد من مادة من مواد بسيطة ، في الحالة القياسية.
من المستحيل حساب القيمة المطلقة للمحتوى الحراري لكل مادة ، ولكن من الممكن حساب التباين في المحتوى الحراري الذي يحدث في التفاعل عن طريق المسعر.
من الضروري أن نتذكر ذلك تم الاتفاق على اعتماد قيمة المحتوى الحراري التي تساوي صفرًا للمواد البسيطة في الحالة القياسية. وبالتالي ، إذا أردنا معرفة المحتوى الحراري لتكوين مادة ما ، فنحن بحاجة فقط إلى معرفة قيمة المحتوى الحراري لتفاعل تكوينها من مواد بسيطة.
على سبيل المثال ، نريد إيجاد المحتوى الحراري لـ 18 جرامًا من الماء ، والذي يتوافق مع 1 مول ، نظرًا لأن كتلته المولية هي 18 جم / مول. للقيام بذلك ، نحتاج أولاً إلى التفاعل لتكوين الماء من مواد بسيطة ، كما هو موضح أدناه:
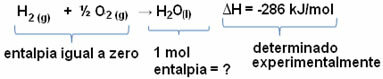
لاحظ أن قيمة التغير في المحتوى الحراري الذي حدث في هذا التفاعل تم تحديده تجريبيًا عن طريق مقياس المسعر وتساوي -286 كيلو جول / مول.
الصيغة التي تحسب هذا التغيير في المحتوى الحراري (ΔH) هي:
ΔH = H.منتجات - حالكواشف
وبالتالي ، نظرًا لأننا نعرف بالفعل قيمة ΔH وأن المحتوى الحراري للمتفاعلات يساوي صفرًا (نظرًا لأنها مواد بسيطة في الحالة القياسية) ، يمكننا بعد ذلك الاستنتاج أن قيمة المحتوى الحراري لـ 1 مول من الماء تساوي التغير في المحتوى الحراري لتفاعل التكوين ، حيث إنه المنتج الوحيد لهذا التفاعل ، كما هو موضح أدناه:
ΔH = H.منتجات - حالكواشف
-286 كيلو جول / مول = HH2O - (حH2 + ح1/2 ا2)
-286 كيلوجول / مول = سمو2يا - 0
حH2O = - 286 كيلوجول / مول
هذا النوع من المحتوى الحراري ، الذي يتم الحصول عليه من المحتوى الحراري للمواد البسيطة في الحالة القياسية ، هو بالتالي المحتوى الحراري القياسي للتكوين (ΔH0).
الآن ، هناك العديد من المواد التي لا تتشكل مباشرة عن طريق تفاعل واحد ، مثل الماء. في مثل هذه الحالات ، يمكن حساب المحتوى الحراري للتكوين من اختلاف المحتوى الحراري للتفاعل.
على سبيل المثال ، NH4يتكون Cl من التفاعل التالي:
نيو هامبشاير3 + حمض الهيدروكلوريك → NH4Cl ΔH = -176 كيلو جول / مول
لاحظ أنه لا يوجد أي من المواد المتفاعلة عبارة عن مادة بسيطة ، لذلك لا يمكننا تخصيص محتوى حراري لهم يساوي صفرًا. نحتاج إلى معرفة المحتوى الحراري لتكوين كل من الكواشف ، حيث يتم تشكيلها من خلال تفاعلات بين المواد البسيطة:
نيو هامبشاير3: ΔH = -46 كيلو جول / مول
حمض الهيدروكلوريك: ΔH = -92.4 كيلوجول / مول
بإضافة هذين المحتوىين الحراريين ، نحصل على قيمة المحتوى الحراري للمتفاعلات ويمكننا إيجاد المحتوى الحراري لـ NH4Cl:
حص = حNH3 + ححمض الهيدروكلوريك
حص = (-46 + (-92.4) كيلوجول / مول)
حص = -138.4 كيلوجول / مول
الاستبدال في الصيغة:
ΔH = H.منتجات - حالكواشف
-176 = حNH4Cl - ( -138,4)
حNH4Cl = - 176 - 138,4
حNH4Cl = -314.4 كيلوجول / مول
في هذه الحالة ، قمنا بتجميع قيم المحتوى الحراري لتكوين المواد المتفاعلة مباشرة لأن نسبة التفاعل كانت 1 جزيء جرامي فقط. ومع ذلك ، إذا كانت كمية الشامات مختلفة في التفاعلات الأخرى ، فسيكون من الضروري أولاً مضاعفة المحتوى الحراري لتكوين المادة المتفاعلة بعدد المولات.
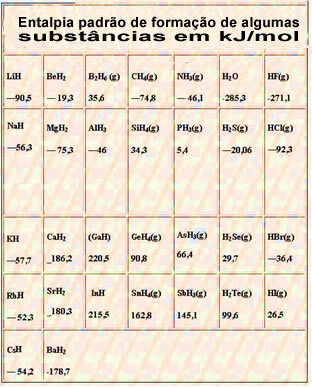
يوجد أدناه جدول يحتوي على المحتوى الحراري القياسي لتكوين بعض المواد عند 25 درجة مئوية و 1 ضغط جوي:
بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm

