في القوى بين الجزيئات، بشكل عام قوات فان دير فال، هناك ثلاثة: المستحث ثنائي القطب ، روابط الهيدروجين وثنائي القطب الدائم الدائم. في هذا النص ، سننظر فقط في القوة الأخيرة من هذه القوى الثلاث:
القوة دائم ثنائي القطب دائم، أو ببساطة، ثنائي القطب ثنائي القطب يحدث فقط في الجزيئات القطبية، أي تلك التي ليس لديها توزيع أحمال موحد على طول سطحها. على سبيل المثال ، في جزيء HCl (غاز الهيدروكلوريك) يتم إزاحة السحابة الإلكترونية نحو ذرة الكلور ، لأنها أكثر كهرسلبية من الهيدروجين.
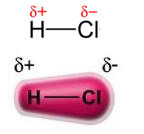
لاحظ أنه يوجد حول ذرة الكلور تراكم للإلكترونات ، مما يؤدي إلى تكوين a قطب سالب، والتي يرمز لها بالحرف اليوناني دلتا (-δ). نتيجة لذلك ، في المنطقة المحيطة بذرة الهيدروجين أ القطب الموجب (+δ), لأنه يحتوي على كثافة إلكترونية منخفضة. ثم يشكل جزيء حمض الهيدروكلوريك أ ثنائي القطب الكهربائي وبالتالي ، عند ملامسة جزيئات حمض الهيدروكلوريك المجاورة الأخرى ، توجد قوة جذب بين القطبين المتقابلين للجزيئات ، كما يمكن رؤيته أدناه:
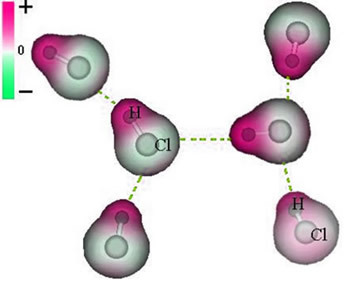
هذه القوة الجاذبة ، التي تنشأ بين النهاية السالبة لثنائي القطب لجزيء واحد مع الطرف الموجب لثنائي القطب لجزيء آخر ، تشكل القوة ثنائية القطب ثنائي القطب..
لذلك ، كما يقول الاسم ، ثنائي القطب دائم ، لذا فهو يحدث فقط في المركبات القطبية. وكلما زادت قطبية الجزيء ، زادت كثافة تفاعلات ثنائي القطب في المادة.
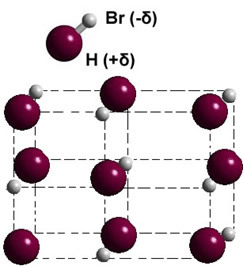
إذا كان في المرحلة الصلبة ، فإن تكوين ثنائي القطب الدائم يوجه موضع كل جزيء في الفضاء ، مكونًا بلورات ثنائية القطب; كما في حالة بروميد الهيدروجين الموضح أدناه:
أمثلة أخرى للمواد القطبية التي لها قوة ثنائي القطب بين جزيئاتها هي: H2S ، CO ، HCCl3، فقط2.
هذه القوة الجزيئية هي من كثافة متوسطة، لأنها أقوى من قوة الجذب المستحثة ثنائي القطب ، ولكنها أقل كثافة من رابطة الهيدروجين. هذا هو السبب في أن نقاط انصهارها وغليانها أعلى من تلك الخاصة بالمواد التي لها قوة ثنائي القطب مستحثة. نظرًا لأن قوة ثنائي القطب الدائم أقوى ، فمن الضروري توفير المزيد من الطاقة لتفاعلات جزيئاتها.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm