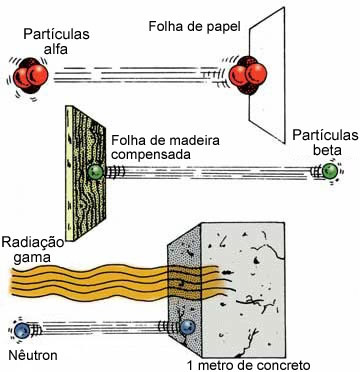
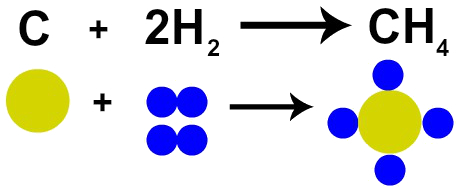
ما يدل على التفاعل هو التحول الذي يحدث في المواد بالنسبة لحالتها الأولية ، وتعتمد هذه التعديلات على نوع التفاعل الذي ستمر به المواد المتفاعلة.
هناك عدة معايير لتصنيف التفاعلات الكيميائية ، يتعلق أحدها بعدد المواد التي تتفاعل (المتفاعلات) وعدد المواد المنتجة (المنتجات). لتوضيح أفضل ، سوف نستخدم الحروف: ال, ب, ج, X, ص.
التوليف أو تفاعل الإضافة: هي تلك التي تنشأ فيها مادتان أو أكثر من منتج واحد.
أ + ب → ج
مثال على هذا التفاعل: عندما يتفاعل المغنيسيوم مع الأكسجين الموجود في الهواء:
2 ملغ + 1 س2(ز) → 2MgO (s)
هذا التفاعل موجود في ومضات التصوير وصواريخ الإشارة التي يمكن التخلص منها.
تفاعل التحليل أو التحلل: في هذا التفاعل تولد مادة واحدة منتجين أو أكثر.
ال → ب + ج
يتم إعطاء بعض ردود الفعل أسماء خاصة:
التحليل الكهربائي: تتحلل المواد بمرور التيار الكهربائي.
التحلل الضوئي: التحلل الكيميائي بالضوء.
الانحلال الحراري: التحلل بفعل الحرارة والنار.
مثال: الوسائد الهوائية هي أجهزة أمان موجودة في العديد من السيارات. عندما نقوم بتشغيل هذا الجهاز ، فإن التحلل السريع لمركب الصوديوم NaN3(ق) ينشأ N2(ز) التي تنفخ الوسائد الهوائية. انظر رد الفعل:
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
2 ن3(ق) → 3 إن2(ز) + 2 نا (ق)
التبادل البسيط أو رد فعل الإزاحة: يحدث عندما تتفاعل مادة بسيطة مع مركب ، مما ينتج عنه مواد جديدة: مركب واحد بسيط وآخر.
أ + س ص → ص + س
مثال: عندما يتم إدخال ورقة من الزنك في محلول مائي من حمض الهيدروكلوريك ، سيتشكل كلوريد الزنك وسيتم إطلاق غاز الهيدروجين.
Zn (s) + 2 HCl (aq) → ZnCl2(عبد القدير) + ح2 (ز)
لاحظ أن الزنك أزاح الهيدروجين ، ومن هنا جاء الاسم "تفاعل الإزاحة".
تفاعل التبادل المزدوج: يتفاعل اثنان من الكواشف مكونين منتجين ، أي إذا تفاعلت مادتان مركبتان مما أدى إلى ظهور مواد مركبة جديدة ، فسيحصلان على هذا الاسم.
AB + XY → Y + XB
مثال: ينتج التفاعل بين حامض الكبريتيك مع هيدروكسيد الباريوم الماء وكبريتات الباريوم.
ح2فقط4 (عبد القدير) + با (أوه)2(عبد القدير) → 2 ح2O (1) + BaSO4(س)
منتج كبريتات الباريوم: BaSO4(ق) ملح أبيض غير قابل للذوبان.
بقلم ليريا ألفيس
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
سوزا ، ليريا ألفيس دي. "أنواع التفاعلات الكيميائية" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/tipos-reacoes-quimicas.htm. تم الوصول إليه في 27 يونيو 2021.