أنت الألدهيدات و ال الكيتونات إنها وظائف عضوية متشابهة جدًا. كلاهما لهما في بنيتهما المجموعة الوظيفية للكربونيل (C = O) ، مع الاختلاف الوحيد ، في حالة الألدهيدات ، تظهر دائمًا في نهاية سلسلة الكربون ، أي أن أحد روابط الكربونيل هو هيدروجين؛ تحتوي الكيتونات على الكربونيل بين ذرتي كربون أخريين.
مجموعة الألدهيدات الوظيفية:المجموعة الوظيفية من الكيتونات:
ا ا
║ ║
ج ج ─ ح ج ج ج
لهذا السبب ، هناك حالات تماثل وظيفي بين الألدهيدات والكيتونات. على سبيل المثال ، نقدم أدناه أيزومرين وظيفيين لهما نفس الصيغة الجزيئية (C3ح6O) ، ولكن أحدهما عبارة عن ألدهيد (بروبانال) والآخر عبارة عن كيتون (بروبانون). شاهد كيف يغير هذا تمامًا خصائصها وتطبيقاتها:
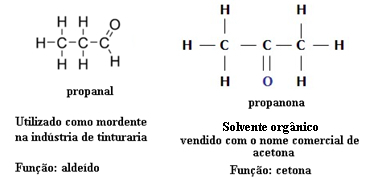
مثال على التماثل الوظيفي بين الألدهيد والكيتون
تخيل أنك في مختبر ووجدت قارورة بها سائل عديم اللون يحتوي فقط على الصيغة الجزيئية C3ح6س. ماذا ستفعل لمعرفة ما إذا كانت كيتون أو ألدهيد؟
لحل مشاكل مثل هذه ، هناك طرق للتمييز بين الألدهيدات والكيتونات بناءً على تفاعل هذه المركبات ضد العوامل المؤكسدة الضعيفة. كما هو مبين أدناه، عند مواجهة المؤكسدات الضعيفة ، تتفاعل الألدهيدات عن طريق التأكسد ، بينما لا تتفاعل الكيتونات.
نقول ذلكتعمل الألدهيدات كعوامل اختزال ، لكن الكيتونات لا تفعل ذلك, يتفاعلون فقط كعوامل اختزال عند ملامسة المؤكسدات النشطة.الألدهيدات + المؤكسدات الضعيفة ← حمض الكربوكسيل
يا س
║ ║
C ─ C ─ H + [O] → C ─ C ─ OH
الكيتونات + المؤكسدات الضعيفة ← لا تتفاعل
ا
║
C ─ C ─ C + [O] → لا يحدث تفاعل
وبناء على ذلك يكفي إجراء هذا التفاعل ومعرفة ما إذا كان المركب يتفاعل أم لا. إذا تفاعل ، نعلم أنه ألدهيد ؛ إذا لم يتفاعل ، فهو كيتون.
بالإضافة إلى ذلك ، فإن المنتجات المتكونة في تفاعلات أكسدة الألدهيد هذه مرئية تمامًا ، مع حدوث تغيرات في اللون ، كما سيظهر لاحقًا.
هناك ثلاث طرق رئيسية للتمييز بين الألدهيدات والكيتونات ، وهي:
1- Tollens رد الفعل: هذا الكاشف هو محلول الأمونيا من نترات الفضة ، أي أنه يحتوي على نترات الفضة (AgNO3) وهيدروكسيد الأمونيوم الزائد (NH4أوه):
AgNO3 + 3 نيو هامبشاير4أوه → أج (NH3)أوه + نيو هامبشاير4في ال3 + 2 ح2ا
Tollens Reactive (سميت على اسم الكيميائي الألماني برنارد تولينز (1841-1918))
كما هو موضح في النص صنع مرآة فضية، عندما يتلامس الألدهيد مع تفاعل Tollens ، فإنه يتأكسد إلى حمض الكربوكسيل المقابل ، بينما يتم تقليل أيونات الفضة إلى Ag0 (فضي لامع). إذا تم إجراء هذا التفاعل ، على سبيل المثال ، في أنبوب اختبار ، فإن هذه الفضة المعدنية سوف تترسب على جدران الأنبوب ، مما يؤدي إلى تكوين فيلم يسمى مرآة الفضة. هذه النتيجة المرصودة جميلة جدًا وتستخدم في عملية تصنيع المرايا الصناعية.
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
يمكن تمثيل التفاعل الذي يحدث على النحو التالي:
يا س
║ ║
ص ج ─ ح + ح2O → R ─ C ─ OH + 2e- + 2 H.+
2 حج+ + 2e- → 2 Ag0
2 نيو هامبشاير3 + 2 ح+ → 2 نيو هامبشاير4+
ا ا
║║
R C ─ H + 2 حج+ + 2 نيو هامبشاير3 + ح2ا → R C ─ OH + 2 حج0 + 2 نيو هامبشاير4+
الألدهيد Tollens رد الفعلحمض الكربوكسيل فضي معدني (مرآة فضية)
من ناحية أخرى ، إذا استخدمنا الكيتون للتفاعل مع تفاعل Tollens ، فلن يحدث تكوين الفضة المعدنية ، لأن الكيتونات لا يمكنها تقليل أيونات Ag.+.
2- Fehling رد الفعل: هذا التفاعل هو محلول أزرق من كبريتات النحاس II (CuSO4) في وسط أساسي ، حيث يتم مزجه مع محلول آخر يتكون من هيدروكسيد الصوديوم (NaOH) وطرطرات الصوديوم والبوتاسيوم (NaOOC-CHOH-CHOH-COOK). يضاف الطرطرات إلى محلول كبريتات النحاس II لتثبيته ومنع ترسبه.
كوسو4 + 2 هيدروكسيد الصوديوم → Na2فقط4 + النحاس (أوه)2
Fehling Reactive (سميت على اسم الكيميائي الألماني هيرمان فون فيلينج (1812-1885))
بالتلامس مع تفاعل Fehling ، يشكل الألدهيد حمض الكربوكسيل بأكسدته ، بينما أيونات النحاس (Cu)2+) الموجود في الوسط يتم تقليله ، مكونًا ترسبًا بني محمر (يشبه الطوب) ، وهو أكسيد نحاسي. من ناحية أخرى ، لا تتفاعل الكيتونات - لأنها لا تستطيع تقليل أيونات النحاس2+.
يا س
║ ║
ص ج ─ ح + 2 نحاس (أوه)2 → ص ج ─ أوه + الحمار2ا + 2 ح2ا
الألدهيد راسب بني محمر
3- رد فعل بنديكت: يتكون هذا التفاعل أيضًا من محلول كبريتات النحاس II (Cu (OH)2) في وسط أساسي ، لكنه يخلط مع سترات الصوديوم.
كما هو الحال مع كاشف Fehling ، في حالة التفاعل بين الألدهيد وكاشف Benedict ، توجد أيضًا أيونات النحاس (Cu2+) الموجود في الوسط الذي يتم اختزاله ويشكل أكسيد نحاسي أحمر.
يستخدم هذا الكاشف على نطاق واسع في الاختبارات للكشف عن وجود ومحتوى الجلوكوز في البول. يحتوي الجلوكوز على مجموعة ألدهيد في هيكله ، لذلك يتفاعل مع كاشف بنديكت الموجود في شرائط لهذه الاختبارات. من هناك ، ما عليك سوى مقارنة لون الشريط مع لون المقياس الموجود على عبوة المنتج.

يستخدم كاشف بنديكت لتحديد محتوى الجلوكوز في البول.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "تمايز الألدهيدات والكيتونات" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/diferenciacao-aldeidos-cetonas.htm. تم الوصول إليه في 27 يونيو 2021.
كيمياء

الألدهيدات ، مركبات الكربونيل ، مجموعة الكربونيل ، الألدهيدات الرئيسية ، الإيثانال ، المواد الخام في صناعة المبيدات الحشرية والأدوية ، الميتانال ، الفورمالديهايد ، صناعة البلاستيك والراتنج.
كيمياء

الكيتونات ، المواد العضوية ، المجموعة الوظيفية للكاربونيل ، الحصول على مذيب المينا ، البروبانون ، أجسام الكيتون في مجرى الدم ، استخلاص الزيوت والدهون من بذور النبات ، المذيبات عضوي.



