Sie Metalle sie sind chemische Elemente, deren physikalische Haupteigenschaft die Fähigkeit besitzt, Elektronen zu verlieren und folglich metallische Kationen zu bilden. Aus diesem Grund können sie zwei Arten von chemischen Bindungen eingehen: die Ionenbindung und die metallische Bindung.
DAS Ionenverbindung tritt auf, wenn ein Metall mit einem Element metallischer Natur interagiert, das a ametallisch oder Wasserstoff. Bei dieser Bindungsart haben wir den Elektronenverlust durch die Metalle und den Elektronengewinn durch die Nichtmetalle oder Wasserstoff.
schon die metallische Bindung zwischen den Atomen eines einzelnen metallischen Elements aufgebaut wird. Diese Art der Bindung tritt nur zwischen den Atomen eines einzelnen Metalls auf und ausschließlich deshalb, weil ein Metall keine chemische Bindung mit einem anderen anderen metallischen Element eingehen kann.
Allgemeine Eigenschaften von Metallen
Feststoffe bei Raumtemperatur, mit Ausnahme von Quecksilber;
Sie sind brillant;
Sie haben hohe Schmelz- und Siedepunkte;
Sie sind im Allgemeinen silberfarben, mit Ausnahme von Gold, das golden ist, und Kupfer, das rötlich ist;
Reine Metalle werden durch Cluster von Atomen (eines einzelnen chemischen Elements) gebildet, die als Kristallgitter bezeichnet werden.
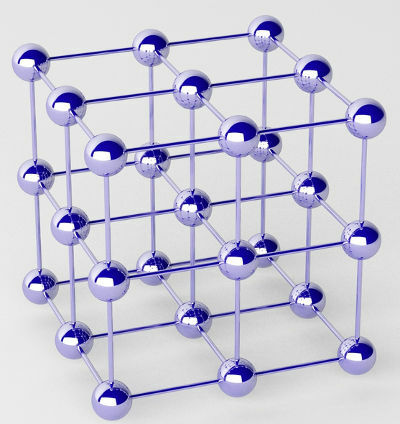
Darstellung des Kristallgitters eines Metalls
Prinzipien der metallischen Bindung
Beim metallische Bindung, die Kristallgitter, die die Metalle bilden, sind eigentlich ein ionischer Cluster (bestehend nur aus Kationen und Elektronen). Die in der Valenzschicht der Metallatome vorhandenen Elektronen werden delokalisiert, dh sie verlassen die Valenzschicht, wodurch das Atom zu einem Kation (Elektronenmangel) wird.
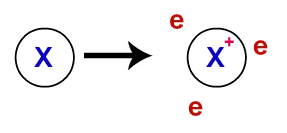
Darstellung delokalisierter Elektronen aus der Valenzschale
Nach der Delokalisierung beginnen die Elektronen der Metallatome die Kationen zu umgeben und bilden ein wahres „Elektronenmeer“. Jedes der in diesem Meer vorhandenen Elektronen hat die Fähigkeit, sich frei durch das Kristallgitter des Metalls zu bewegen.

Darstellung des Elektronenmeermodells
HINWEIS: Elektronen „aus dem Meer“ können das Kristallgitter nicht verlassen und sich durch dieses hindurch bewegen.
Eigenschaften von Metallen, die durch metallische Bindung begründet sind
a) Formbarkeit
Durch ein Metall ist es möglich, Bleche unterschiedlicher Dicke und Bleche herzustellen. Dank dieser Eigenschaft von Metallen können wir verschiedene Gegenstände wie Messer, Schwerter usw.

Die Klinge eines Schwertes besteht aus einem Metall
b) Leitfähigkeit
Metalle sind im Allgemeinen gute Leiter von elektrischem Strom und Wärme. Wenn ein Metall mit einer Wärmequelle oder einer elektrischen Stromquelle in Kontakt kommt, kann es diese leiten.

Eine Aluminiumpfanne in der Flamme eines Ofens wird aufgrund der Leitfähigkeit vollständig heiß.
c) Duktilität
Durch ein Metall können wir Drähte herstellen. Die Verwendung eines Metalls in Form von Drähten erleichtert seine Verwendung, insbesondere in Bezug auf die elektrische Leitfähigkeit.

Zur Herstellung von Drähten kann ein Metall wie Kupfer verwendet werden.
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-metalica.htm
