Molekylernes polaritet er et meget vigtigt aspekt, da stoffernes egenskaber bestemmes blandt andet af det faktum, at deres molekyler er polære eller ikke-polære.
Bestemmelsen af polariteten af et molekyle kan udføres ved hjælp af Dipole Moment eller Resulterende Dipole Moment, hvis symbol er 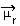 . Hvis vi bare taler om dipolmomentet for hver binding i molekylet, så er symbolet det græske bogstav mi (µ).
. Hvis vi bare taler om dipolmomentet for hver binding i molekylet, så er symbolet det græske bogstav mi (µ).

Molekylet vil være ikke-polært, hvis dipolmomentet er lig med nul, men hvis det er ikke-nul, betyder det, at det er polært.

Der er to vigtige ting at overveje ved bestemmelse af dette resulterende dipolmoment. Lad os se, hvad de er:
1) elektronegativitetsforskel mellem atomerne i de elementer, der deltager i reaktionen. For eksempel har HF-molekylet en markant forskel i elektronegativitet, da fluor tiltrækker meget mere end hydrogen paret elektroner i bindingen. Således er fordelingen af ladninger ikke symmetrisk med elektriske dipoler.
Denne dipol er repræsenteret af en vektor, der vender mod den ende, der koncentrerer flest elektroner, det vil sige fra det mindste til det mest elektronegative atom. Så i dette tilfælde vil vektoren, som er den eneste, være den resulterende vektor, som angivet nedenfor:
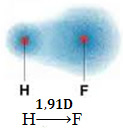
Bemærk, at vektorværdien er den samme som dipolmomentet, der er angivet i afskedsenhed (D = 3,33. 10-30 coulomb. undergrundsbane). Da dipolmomentet ikke er nul, er molekylet og bindingen polar.
Stop ikke nu... Der er mere efter reklamen;)
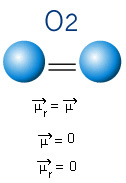
I nedenstående molekyle har vi også et molekyle med kun to atomer, men i dette tilfælde svarer det til et simpelt stof, det vil sige det er kun dannet af en type element. Derfor er der ingen elektronegativitetsforskel; atomer tiltrækker også elektroner, som er symmetrisk fordelt. Det resulterende dipolmoment er lig med nul, så både bindingen og molekylet er apolar.
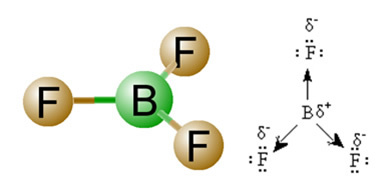
2) Molekylgeometridet vil sige det rumlige arrangement af vektorerne. BF-molekylet3 den har tre polære bindinger, hvor fluor er den mest elektronegative og således har vektorerne rettet mod det. Da det rumlige arrangement af atomerne er trigonal fladt, får dette imidlertid elektronerne til at have en symmetrisk fordeling omkring det centrale atom. Resultatet er således, at disse tre vektorer annullerer hinanden, og dipolmomentet er lig med nul. Derfor er BF-molekylet3 é undskyld.
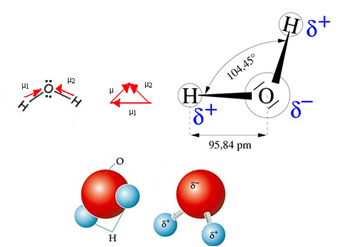
Vandmolekylet har to vektorer, men dets rumlige geometri er ikke flad, men i form af en V. Bemærk i den følgende figur, at på denne måde fjerner deres vektorer ikke hinanden, elektronerne fordeles asymmetrisk og mere koncentreret i det mest elektronegative atom, som er ilt. Således er dipolmomentet forskelligt fra nul, og vandmolekylet er polar:
Af Jennifer Fogaça
Uddannet i kemi