Алотропията е свойството, което някои химични елементи трябва да образуват различни прости вещества, т.е. вещества, образувани само от един вид елемент.
Наричат се различните образувани вещества форми или алотропни сортове или на алотропи.
Тези алотропи могат да се различават по две основни причини, а именно:
1. Неговата томичност: броят на атомите, които изграждат молекулата;
2. Структура: Разположението на атомите в кристалната решетка е различно за всяка алотропна форма.
Сярата (S) е елемент, който има най-голямо разнообразие от алотропни форми, включително молекули на S2, С4, С6и с8, които се различават по броя на атомите във всяка молекула. Всички тези серни алотропи могат да бъдат намерени на места, склонни към вулканични изригвания, между температурите от 444,6 ° C и 1000 ° C. Въпреки това, над 1000 ° C, S2 започва да се дисоциира в атомна сяра (S0).
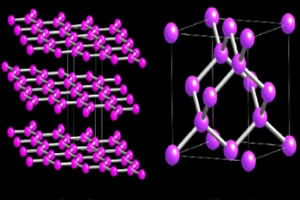
Най-важните алотропи на сярата обаче са две: o ромбична сяра това е моноклинна сяра.
И двете се образуват от една и съща молекулна формула, с8, разликата между двете е в пространственото разположение на атомите в кристалната решетка.

Както можете да видите на изображението по-долу, ромбичната сяра е под формата на жълти и прозрачни кристали, докато моноклинната е с форма на игла и непрозрачна:

Не спирайте сега... Има още след рекламата;)
Между тези две алотропни форми на сяра, ромбичният е най-често срещаният. Той има плътност, равна на 2,07 g / cm3 при 20 ° C, точка на топене равна на 112,8 ° C и точка на кипене равна на 444,6 ° C.
Моноклиниката има плътност 1,96 g / cm3 при 20 ° C, точка на топене равна на 119 ° C и същата точка на кипене като ромбичната сяра. При околни условия и двете са жълт прах, без мирис, неразтворим във вода и много разтворим в въглероден сулфид (CS2).

Сярата има няколко промишлени приложения, като основната е в производството на сярна киселина, H2САМО4, което от своя страна се използва широко при производството на различни продукти. Поради икономическото си значение консумацията на сярна киселина често може да показва степента на развитие на дадена държава.
Друго важно приложение на сярата е вулканизирането на каучук, което е добавянето на 2 до 30% сяра към каучука, под нагряване и в присъствието на катализатори, образувайки триизмерен полимер, като сяра служи като мост между веригите въглероден. Това прави естествения каучук по-устойчив и гъвкав, готов за различни цели, като например изработка на гуми.
Сярата се използва и при производството на черен прах, инсектициди, козметика и фармацевтични продукти като антибиотици на основата на сулфа.
* Редакционни кредити за изображението: emran / Shutterstock.com
От Дженифър Фогаса
Завършва химия
Искате ли да се позовавате на този текст в училище или академична работа? Виж:
FOGAÇA, Дженифър Роча Варгас. "Сярна алотропия"; Бразилско училище. Наличен в: https://brasilescola.uol.com.br/quimica/alotropia-enxofre.htm. Достъп на 28 юни 2021 г.
Химия
Какво е алотропия, прости вещества, газов кислород, озон, алотропни форми, химичен елемент кислород, ултравиолетови лъчи от слънцето, диамант, графит, атомност, бял фосфор.